题目内容
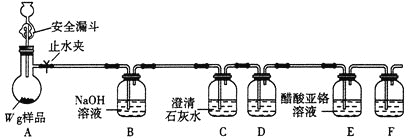
【题目】常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
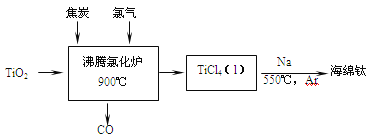
(1)TiCl4遇水强烈水解,写出其水解的化学方程式___________________。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是___________。
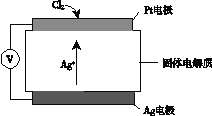
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为_______。
③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3+ 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为____mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K=_____________。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是___________(填序号)。
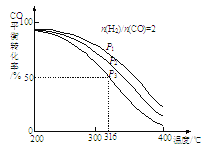
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
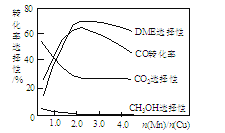
催化剂中n(Mn)/n(Cu)约为___________时最有利于二甲醚的合成。
【答案】TiCl4+ 4H2O=Ti(OH)4↓+ 4HCl↑或TiCl4+ 3H2O=H2TiO3↓+ 4HCl↑ 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用 Cl2+ 2e-+ 2Ag+= 2AgCl 0.5 c(CH3OCH3)c(H2O)/[c(H2)4c(CO)2] a 2.0
【解析】
(1) TiCl4遇水强烈水解,生成氯化氢和氢氧化钛,化学方程式是TiCl4+ 4H2O=Ti(OH)4↓+ 4HCl↑;或TiCl4+ 3H2O=H2TiO3↓+ 4HCl↑;
(2)①氯气与钢瓶中的铁反应生成的氯化铁对氯气与苯的反应有催化作用,所以钢瓶表面氯与苯的反应明显加快;
②根据图可知,银离子向通入氯气的一极移动,说明通入氯气的一极是阴极,所以氯气得到电子生成氯离子与银离子反应生成氯化银沉淀,电极反应式是Cl2+ 2e-+ 2Ag+= 2AgCl;
③根据KClO3+ 6HCl(浓) = KCl + 3Cl2↑+ 3H2O,当生成6.72LCl2(标准状况下)物质的量是0.3mol时,消耗氯酸钾的物质的量是0.1mol,氯酸钾中Cl元素的化合价从+5价降低到0价,得到5个电子,则0.1mol氯酸钾参加反应得到电子的物质的量是0.5mol,所以该过程中转移的电子的物质的量为0.5mol;
(3)①根据平衡常数的定义,可知该反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(H2)4c(CO)2];
②a、压强一定时,温度升高,CO的转化率降低,说明升高温度,平衡逆向移动,则该反应是放热反应,△H <0,正确;
b、压强增大,平衡正向移动,则CO的转化率增大,所以P1>P2>P3,错误;
c、若在P3和316℃时,起始时n(H2)/n(CO)=3,即增大氢气的浓度而CO的浓度不变,则平衡正向移动,所以达到平衡时CO的转化率增大,大于50%,错误;
答案选a;
③根据图可知,当CO的转化率最大、DME的选择性最大值时对应的横坐标大约在2.0附近,所以n(Mn)/n(Cu)约为2.0时最有利于二甲醚的合成。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1 L密闭容器中加入2 mol CO、4 mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1 mol CO生成的同时有1 mol O-H键断裂
(3)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10 min内,用H2O(g)表示的化学反应速率v(H2O)=_________mol/(L·min);
span>②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________;
③在其他条件不变的情况下,若30 min时向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_______移动(填“正向”、“逆向”或“不”);
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________。