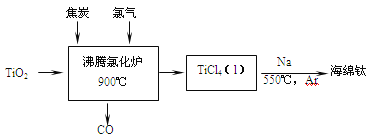
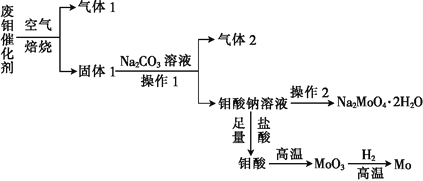
题目内容
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组设计了如下图所示的实验装置用于制备ClO2。
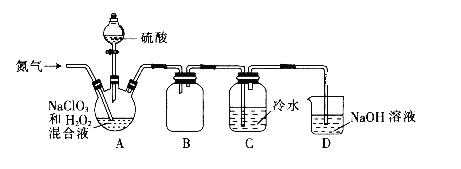
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是__________。
②装置B的作用是_________。
③当看到装置C中导管液面上升时应进行的操作是________。
(2)用0.1000mol·L-1的Na2S2O3标准液测定装置C中ClO2溶液的浓度。原理:2ClO2+10I-+8H+=5I2+2Cl-+4H2O , I2+2S2O32- = 2I- +S4O62-
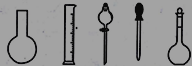
①配制0.1000molL-1的Na2S2O3标准溶液时所需仪器除在如图所示的仪器中进行选择外,还需用到的玻璃仪器是________(填仪器名称)
②在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度___0.1000molL-1(填“>”、“<”或“=”,下同);若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___0.1000molL-1。
③取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___________作指示剂,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________ mol·L-1。
【答案】稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸 防止倒吸(或作安全瓶) 加大氮气的通入量 烧杯、玻璃棒 < < 淀粉溶液 0.04
【解析】
(1)NaClO3和H2O2混合液在装置A中发生反应制取ClO2,B是安全瓶,防止倒吸,C中的冷水用来吸收ClO2,D中的NaOH溶液进行尾气处理。
(2)用酸碱中和滴定的原理进行氧化还原滴定。先配制0.1000mol/L的Na2S2O3标准溶液,根据配制步骤确定所需仪器,根据c=![]() 确定配制的溶液浓度偏高还是偏低;用方程式计算ClO2的浓度。
确定配制的溶液浓度偏高还是偏低;用方程式计算ClO2的浓度。
(1)①由于ClO2在混合气体中的体积分数大于10%就可能发生爆炸,所以通入氮气除了可以起到搅拌作用外,还起到了稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸的作用。
②装置B的作用是作安全瓶,防止倒吸。
③若发生倒吸,即看到装置C中导管液面上升时,应加大氮气的通入量。
(2)①用固体溶质配制一定物质的量浓度的溶液所需的玻璃仪器有容量瓶、烧杯、玻璃棒、胶头滴管,图示中有容量瓶和胶头滴管,缺少的玻璃仪器是烧杯、玻璃棒。
②根据c=![]() ,若定容时仰视刻度线,会使溶液体积偏大,则所得溶液浓度<0.1000molL-1;若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,使溶质的物质的量变小,则所得溶液浓度<0.1000molL-1。
,若定容时仰视刻度线,会使溶液体积偏大,则所得溶液浓度<0.1000molL-1;若Na2S2O3标准溶液在转移至容量瓶时,洒落了少许,使溶质的物质的量变小,则所得溶液浓度<0.1000molL-1。
③根据反应2ClO2+10I-+8H+=5I2+2Cl-+4H2O ,I2+2S2O32- = 2I- +S4O62-,可找到关系:2ClO2~5I2 ~10S2O32-,即n(ClO2)=![]() =
=![]() =4.000×10-4mol,浓度为c=
=4.000×10-4mol,浓度为c=![]() =
=![]() =0.04mol/L。
=0.04mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应;
②用水一乙醇液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 2.10 | 2.50 | 1.40 |
滴定后读数/mL | 22.00 | 22.50 | 21.50 |
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________________________________。
(4)气体样品中CO的体积分数为__________(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)
(5)下列操作会造成所测CO的体积分数偏大的是__________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10min内,用H2O(g)表示的化学反应速率v(H20)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________。
③在其它条件不变的情况下,若30min时改变温度为T
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.
【题目】有关元素W、X、Y、Z的信息如下,请用化学用语完成下列问题:
元素 | 信息 |
W | 所在主族序数与所在周期序数之差为4,其单质在常温下呈黄绿色 |
X | X+的电子层结构与Ne相同 |
Y | 生活中常见的金属,其制品在潮湿的空气中会生锈 |
Z | 地壳中含量最多的金属元素 |
(1)请写出Z元素在周期表中的位置________。请写出Z高价氧化物的水化物与X最高价氧化物水化物反应的离子方程式________。
(2)X在空气中加热,生成一种淡黄色固体,该固体的电子式是________。
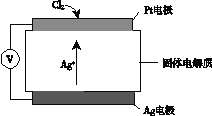
(3)以铜棒、石墨为电极材料,YW3溶液为电解质溶液,形成如图所示的原电池,则该原电池正极的电极反应式为________。如何检验正极反应的产物离子,请简述操作过程及现象________,________。
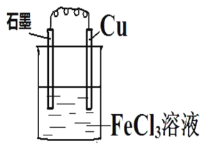
(4)Y和Z单质混合物质量为3.28g,总物质的量为0.1mol。加入足量盐酸溶解,再加入适量H2O2溶液,然后加入氨水恰好完全沉淀,过滤、洗涤、干燥,得到固体的质量为________g。加入H2O2溶液反应的离子方程式为________。