题目内容
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1 L密闭容器中加入2 mol CO、4 mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1 mol CO生成的同时有1 mol O-H键断裂
(3)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10 min内,用H2O(g)表示的化学反应速率v(H2O)=_________mol/(L·min);
span>②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________;
③在其他条件不变的情况下,若30 min时向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_______移动(填“正向”、“逆向”或“不”);
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________。
【答案】2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1352.8 kJ/mol 不能 d 0.025 ![]() 50% 不 CH3OCH3-12e-+16OH-=2CO32-+11H2O
50% 不 CH3OCH3-12e-+16OH-=2CO32-+11H2O
【解析】
(1)根据盖斯定律,将已知热化学方程式叠加,可得待求反应的热化学方程式;
(2)①根据反应自发进行的判断依据分析;
②根据反应达到平衡状态时,物质的浓度不变、物质的含量不变等分析判断;
(3)①0~10 min内H2物质的量变化△n(H2)=6 mol-4.5 mol=1.5 mol,先计算H2表示的反应速率,再根据速率之比等于化学方程式计量数之比,可得用H2O表示的反应速率;
②图表中计算20 min时二氧化碳消耗物质的量1 mol,同时生成1 mol甲醇,30 min甲醇物质的量为1 mol,则20 min反应处于平衡状态,结合物质转化关系计算各种气体的平衡浓度,可得氢气转化率和平衡常数;
③在其它条件不变的情况下,若30 min时向容器中再充入1 mol CO2(g)和1 mol H2O(g),计算此时浓度商,并与平衡常数比较,判断反应进行方向;
(4)甲醚作为燃料电池的原料,甲醚在负极失电子发生氧化反应,依据电极反应写出电极反应。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
根据盖斯定律,将①×3+②×2,整理可得2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1352.8 kJ/mol;
(2)①根据方程式2CO(g)+4H2(g)CH3OCH3(l)+H2O(l) ΔH=+71 kJ/mol可知:该反应的正反应是气体体积减小的吸热反应,ΔH>0,ΔS<0,反应的自由能ΔG=ΔH-TΔS>0,所以反应不能自发进行;
②a.只有反应物为气体,加入的两种气体的物质的量的比等于反应消耗的二者的物质的量的比,混合气体的平均相对分子质量始终不变,因此不能据此说明反应处于平衡状态,a错误;
b.由于两种气体的起始量和变化量之比相同,CO和H2的转化率始终相等,与反应是否达到平衡无关,因此不能说明反应是否处于平衡状态,b错误;
c.由于生成物都是液体,气体体积分数始终不变,CO和H2的体积分数保持不变,因此不能说明反应是否处于平衡状态,c错误;
d.反应前后气体体积不变,气体质量发生变化,当混合气体的密度保持不变时,说明反应处于平衡状态,d正确;
e.1 mol CO生成的同时有1 mol O-H键断裂,只能说明反应逆向进行,不能说明正、逆反应速率相同,反应处于平衡状态,e错误;
故合理选项是d;
(3)①0~10 min内氢气物质的量变化△n(H2)=6 mol-4.5 mol=1.5 mol,v(H2)= =0.075 mol/(L·min),由于化学反应速率之比等于化学方程式计量数之比,所以v(H2O)=
=0.075 mol/(L·min),由于化学反应速率之比等于化学方程式计量数之比,所以v(H2O)=![]() v(H2)=
v(H2)=![]() ×0.075 mol/(L·min)=0.025 mol/(L·min);
×0.075 mol/(L·min)=0.025 mol/(L·min);
②图表中20 min时CO2反应消耗1 mol,同时生成1 mol甲醇,30 min甲醇物质的量也是1 mol,说明20 min反应处于平衡状态。20 min时CO2反应1 mol,同时消耗3 mol H2,反应产生1 mol CH3OH和1 mol H2O,则此时各种气体的物质的量浓度:c(CO2)=![]() =0.5 mol/L,c(H2)=
=0.5 mol/L,c(H2)=![]() =1.5 mol/L,c(CH3OH)=c(H2O)=
=1.5 mol/L,c(CH3OH)=c(H2O)=![]() =0.5 mol/L,故该条件下反应的化学平衡常数K=
=0.5 mol/L,故该条件下反应的化学平衡常数K=![]() =
=![]() ;平衡时H2的转化率=
;平衡时H2的转化率=![]() ×100%=50%;
×100%=50%;
③在其它条件不变时,若30 min时向容器中再充入1 mol CO2(g)和1 mol H2O(g),Qc=![]() =
=![]() = K,说明化学平衡不移动;
= K,说明化学平衡不移动;
(4)若用甲醚作为燃料电池的原料,甲醚在负极失电子,发生氧化反应,在碱性介质中电池负极的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O。

 名师点拨卷系列答案
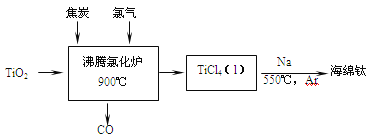
名师点拨卷系列答案【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
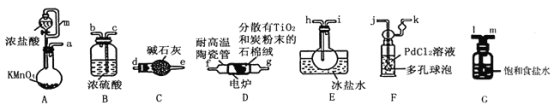
已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
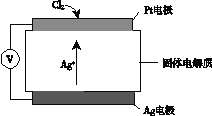
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
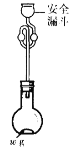
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)
【题目】有关元素W、X、Y、Z的信息如下,请用化学用语完成下列问题:
元素 | 信息 |
W | 所在主族序数与所在周期序数之差为4,其单质在常温下呈黄绿色 |
X | X+的电子层结构与Ne相同 |
Y | 生活中常见的金属,其制品在潮湿的空气中会生锈 |
Z | 地壳中含量最多的金属元素 |
(1)请写出Z元素在周期表中的位置________。请写出Z高价氧化物的水化物与X最高价氧化物水化物反应的离子方程式________。
(2)X在空气中加热,生成一种淡黄色固体,该固体的电子式是________。
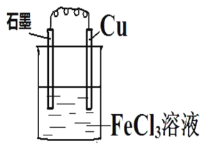
(3)以铜棒、石墨为电极材料,YW3溶液为电解质溶液,形成如图所示的原电池,则该原电池正极的电极反应式为________。如何检验正极反应的产物离子,请简述操作过程及现象________,________。
(4)Y和Z单质混合物质量为3.28g,总物质的量为0.1mol。加入足量盐酸溶解,再加入适量H2O2溶液,然后加入氨水恰好完全沉淀,过滤、洗涤、干燥,得到固体的质量为________g。加入H2O2溶液反应的离子方程式为________。