��Ŀ����
����Ŀ����V1 mL 2.0 mol��L��1 HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ(ʵ����ʼ�ձ���V1��V2��50 mL)������˵����ȷ���ǣ� ��
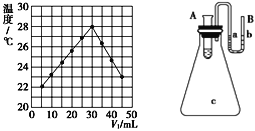
ͼ1 ͼ2
A. ��ͼ1��֪ʵ��ʱ�Ļ����¶ȵ���22 ����
B. ��ͼ1��֪��NaOH��Һ�����ʵ���Ũ��Ϊ3.0molL-1
C. ͼ2�������װ��ˮ��С�Թ��зֱ�����ռ���塢Ũ���ᡢ����粒��嶼��ʹa��Һ�����b��Һ��
D. ����Һ�����ݽ���Ϊ4.18 J/��g��������Һ�ܶȽ���Ϊ1g/mL����÷�Ӧ���к��ȵ���ֵΪ125.4 kJ/mol
���𰸡�B
��������
A. ��ʵ���м���5 mLHCl��Һ���¶�Ϊ22�棬10 mLHCl��Һ���¶�Ϊ23�棬�Ʋ����ʼ�¶���21�棬A�����
B. ǡ�÷�Ӧʱ�μӷ�Ӧ��������Һ�������30 mL����V1+V2= 50 mL��֪�����ĵ�����������Һ�����Ϊ20 mL��
��ǡ�÷�Ӧʱ����������Һ�����ʵ����ʵ�����n.
HCl+NaOH=NaCl+H2O
1 1
2.0molL1��0.03 L n
��n=2.0 molL1��0.03 L=0.06 mol������Ũ���ǣ�![]() =3.0 mol/L��B����ȷ��
=3.0 mol/L��B����ȷ��
C. �ռ��Ũ��������ˮ���ȣ������������ˮ���ȣ��������������ԭ����֪��ͼ2�������װ��ˮ��С�Թ��зֱ��������狀���ƿ�������ѹǿ��С���¶Ƚ��ͣ�ʹa��Һ�����b��Һ�棬�������ռ��Ũ�������ƿ�������ѹǿ�����¶����ߣ�ʹa��Һ�����b��Һ�棬C�����
D.�к�����ָϡ��ǿ����ϡ��ǿ����Һ�����кͷ�Ӧ����1molˮ���ų�����������ֵ��57 kJ/mol���ң�D�����
��ѡB��






