题目内容
【题目】(1)Co、Cu、Zn都是过渡元素,可作为中心原子形成多种配合物,下列不能作为配合物配位体的是______;
A.H2O B.NH3 C.CH4 D.Cl﹣
(2)用氢键表示式写出氨水中NH3分子与水分子间可能存在的氢键____;
(3)Cu元素可形成[Cu(NH3)4]SO4,其中存在的化学键类型有______(填序号);
①配位键 ②氢键 ③极性共价键 ④非极性共价键 ⑤离子键
(4)甲烷晶体的晶胞结构如下图,下列有关说法正确的是_______。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键

(5)下图表示的是SiO2的晶胞结构(白圈代表硅原子,黑点代表氧原子),判断在30g二氧化硅晶体中含______mol Si-O键。如果该立方体的边长为a cm,用NA 表示阿伏加德罗常数,则SiO2晶体的密度表达式为__________________g/cm3 。

【答案】C N—H…O O—H…N①③⑤AB2 mol480/(NA·a3)
【解析】
(1)A.H2O是共价化合物,是由原子和氢原子形成共价键,电子式为![]() ,有孤对电子,可以作为配体,故A不选;B.NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为
,有孤对电子,可以作为配体,故A不选;B.NH3是共价化合物,氮原子分别与3个氢原子通过一对共用电子对结合,NH3电子式为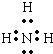 ,有孤对电子,可以作为配体,故B不选;C.碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为
,有孤对电子,可以作为配体,故B不选;C.碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为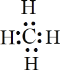 ,无孤对电子,不可以作为配体,故C正确;D.Cl-为氯原子得到1个电子形成的阴离子,电子式为
,无孤对电子,不可以作为配体,故C正确;D.Cl-为氯原子得到1个电子形成的阴离子,电子式为![]() ,有孤对电子,可以作为配体,故D不选;故选C。
,有孤对电子,可以作为配体,故D不选;故选C。
(2)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N,氨水中NH3分子与水分子间形成的可能存在的氢键N-H…O、O-H…N;
(3)[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与SO42-之间的化学键为离子键,[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,[Cu(NH3)4]SO4,因此,本题正确答案是:①③⑤;
(4)A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体,分子晶体间的作用力为分子间作用力,故A正确;B. 以该甲烷晶胞为单元,位于顶点的某1个甲烷分子与其距离最近的甲烷分子有3个,而这3个甲烷分子在面心上,因此每个都被共用2次,故与1个甲烷分子紧邻的甲烷分子有3×8×![]() =12个,故B正确;C. 甲烷是分子晶体,熔化时需克服范德华力,故C错误;故选AB;
=12个,故B正确;C. 甲烷是分子晶体,熔化时需克服范德华力,故C错误;故选AB;
(5)一个硅原子连四个O,所以就有四个硅氧,即1mol SiO2含4mol硅氧键,30g二氧化硅为0.5mol, 30g二氧化硅中的含有0.5mol×4=2mol Si-O键;由晶胞图可得出Si原子个数为![]() ;一个晶胞中有8个SiO2分子,1mol SiO2的质量为60g,一个晶胞的质量为
;一个晶胞中有8个SiO2分子,1mol SiO2的质量为60g,一个晶胞的质量为![]() ,除以体积得出密度为480/(NA·a3) g/cm3。
,除以体积得出密度为480/(NA·a3) g/cm3。