题目内容
X、Y、Z、D、E、G六种短周期元素的原子序数依次递增。X、Y、D元素的基态原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质和ED2化合物均具有漂白性;R元素的M层全满,N层只有1个电子。
请回答下列问题:(用对应的元素符号表示)
(1)R元素在元素周期表分区中属于______区元素,Y、Z、D三种元素中电负性由小到大的顺序是_________。
(2)X3D+的中心原子杂化轨道类型是__________,该离子的立体构型是 。
(3)向RED4的水溶液中加入ZX3的水溶液至过量,有关反应的离子方程式是 。
(4)向RG2的水溶液通入ED2,产生白色沉淀RG,该反应的离子方程式是 。
(1)ds;C<N<O(2)sp3;三角锥形(或三棱锥形)(3)Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3==[Cu(NH3)4]2++2OH-(4)2Cu2++2Cl-+SO2+2H2O==2CuCl↓+4H++SO42-
解析试题分析:由题意知,G的单质和ED2化合物均具有漂白性且D、E属于同族元素,故G为Cl,ED2为SO2,即E为S,D为O,又X、Y、D元素的基态原子中电子层数与未成对电子数均相等,X、Y、D、原子序数依次递增,故X为H ,Y为C,Z为N。R元素的M层全满,N层只有1个电子,即29号元素铜。
(1)Cu在元素周期表中属于ds区元素,C、N、O三种元素中电负性由小到大的顺序为C<N<O(2)H3O+的中心原子杂化轨道类型是sp3;该离子的立体构型是三角锥形(3)由题意知,CuSO4中通入过量NH3,铜离子和氨水反应先生成氢氧化铜沉淀,继续加热氨水时氢氧化铜沉淀和氨水反应生成[Cu(NH3)4]2+离子溶液,离子方程式Cu2++2NH3·H2O==Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3==[Cu(NH3)4]2++2OH-(4)由题意知,向CuCl2通入SO2产生CuCl沉淀,SO2发生氧化反应,生成SO42-,离子方程式2Cu2++2Cl-+SO2+2H2O==2CuCl↓+4H++SO42-。
考点:物质推断,物质结构、元素及化合物知识

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案(本题共12分)
我国钾长石(KAlSi3O8)的资源比较丰富。工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l) +KAlSi3O8 (s)  KCl (l)+NaAlSi3O8 (s)。
KCl (l)+NaAlSi3O8 (s)。
完成下列填空:
(1)硅原子的最外层电子占据了 个轨道,有 种能量。
(2)氯化钠的熔点比氯化钾的 (填“高”或“低”),原因是 。
(3)把反应中涉及到的六种元素的原子半径按从小到大的顺序排列 。
(4)参与上述反应且位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素是 。
(5)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
| 时间(h) 钾元素 温度 熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
①分析数据可以得出,该制备氯化钾的反应是 (填“放热”或“吸热”)反应。
②计算890℃时,氯化钠的平衡转化率 。(式量:KAlSi3O8–278 NaAlSi3O8 –262)
③950℃时,提高熔出钾的速率可以采取的措施是 (写出两种)。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| | Q | R | |
| T | | | W |
(1)T的原子结构示意图是______。用化学方程式表示工业常用冶炼T单质的原理是______。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中存在的共 价键的类型是______。
(3)元素的非金属性:Q______W(填“强于”或“弱于”),结合方程式简述其原因是______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物,实验步骤:将盛有甲的试管倒扣在水槽中,______。
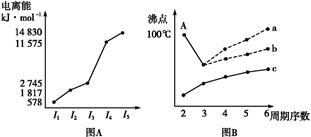

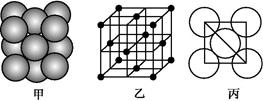
 。请回答下列问题:
。请回答下列问题: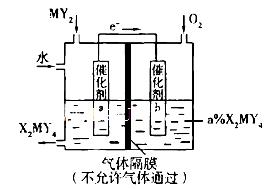
 Si(s)+2CO(g)
Si(s)+2CO(g)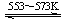 SiHCl3(l)+H2(g) + Q(Q>0)
SiHCl3(l)+H2(g) + Q(Q>0) Si(纯)+3HCl(g)
Si(纯)+3HCl(g)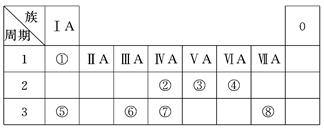
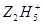 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+,