题目内容
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是 (填元素符号),B元素在元素周期表中的位置 。
(2)D与E可形成化合物D2E,该化合物的电子式为 。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与碳反应,该反应的化学方程式为 ________________________________。
(4)比较E、F气态氢化物的稳定性: > (用分子式表示)。
(5)请写出:CH3OH和O2与KOH溶液组成的燃料电池总反应式: 。
(1)Na 1分 第二周期VA族 2分
(2)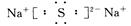
(3)Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)HCl>H2S
(5)2CH3OH+3O2+4OH-=2CO32-+6H2O
解析试题分析:由A、C形成的化合物常温下为液态,猜测其为H2O,A是H,C 是O,故B是N,E是S,D是Na ,F 是Cl。
(1)原子半径最大的是钠,N元素在元素周期表中的位置是第二周期VA族。
(2)D(Na)与E(S)可形成化合物为Na2S,电子式为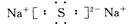 ,属于离子晶体。
,属于离子晶体。
(3)A(H)、C(O)、E(S)三种元素形成的一种常见化合物,其浓溶液是浓硫酸。所以与铜的化学方程式是Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)E(S)、F(Cl)气态氢化物分别是H2S、HCl,同一周期,气态氢化物的稳定性逐渐增强,所以HCl>H2S。
(5)CH3OH和O2反应的化学方程式是: 2CH3OH+3O2=2CO2+4H2O ① 电解质溶液为KOH溶液,CH3OH反应生成的CO2会和KOH反应,CO2+2KOH=K2CO3+H2O ②
①+②×2,得:甲醇燃料电池的总化学反应为:2CH3OH+3O2+4KOH=6H2O+2K2CO3
总离子反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O
考点:考查元素推断。

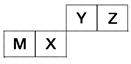
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。
(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
| A.M、X、Z形成的单质熔沸点 M>X>Z |
| B.氢化物的热稳定性:W>X |
| C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同 |
| D.Z元素含氧酸的酸性一定强于Y元素的含氧酸 |
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的
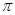 键数目为 。
键数目为 。(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目 。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ?mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ?mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 。