题目内容
(本题共12分)
我国钾长石(KAlSi3O8)的资源比较丰富。工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l) +KAlSi3O8 (s)  KCl (l)+NaAlSi3O8 (s)。
KCl (l)+NaAlSi3O8 (s)。
完成下列填空:
(1)硅原子的最外层电子占据了 个轨道,有 种能量。
(2)氯化钠的熔点比氯化钾的 (填“高”或“低”),原因是 。
(3)把反应中涉及到的六种元素的原子半径按从小到大的顺序排列 。
(4)参与上述反应且位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素是 。
(5)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
| 时间(h) 钾元素 温度 熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
①分析数据可以得出,该制备氯化钾的反应是 (填“放热”或“吸热”)反应。
②计算890℃时,氯化钠的平衡转化率 。(式量:KAlSi3O8–278 NaAlSi3O8 –262)
③950℃时,提高熔出钾的速率可以采取的措施是 (写出两种)。
(1)3 2
(2)高 钾离子半径大于钠离子,半径越大,离子键键能越低,熔点越低。
(3)O<Cl<Si<Al<Na<K
(4)Na
(5)①吸热 ②0.074 ③充分搅拌 将钾长石充分粉碎
解析试题分析:(1)硅原子的最外层电子排布式为3S23P2占据了3个轨道,有2种能量。
(2)钾离子半径大于钠离子,半径越大,离子键键能越低,熔点越低。氯化钠的熔点比氯化钾的高。
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,故原子半径K>Na>Al>Si>Cl>O。
(4)Na、Al、Si、Cl四种元素处于同一周期,氢氧化钠能与氢氧化铝、硅酸、高氯酸反应生成相应的盐与水,故答案为:Na;
(5)①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,升高温度平衡向吸热方向移动,故正反应为吸热反应,故答案为:吸热;② 1gKAlSi3O8 (s)中K的质量为:39/278=0.140g,
NaCl (l) +KAlSi3O8 (s)  KCl (l)+NaAlSi3O8 (s)。
KCl (l)+NaAlSi3O8 (s)。
开始 2g 1g 0
平衡 0.699*74.5*0.140/39
转化 0.699*74.5*58.5*0.140/39*74.5 0.699*74.5/39
求得 0.699*74.5*58.5*0.140/39*74.5 =0.148,氯化钠的平衡转化率=0.148/2=0.074。
③950℃时,提高熔出钾的速率可以采取的措施是充分搅拌,反应物充分接触,反应速率加快,或将钾长石粉粹成更小的颗粒,增大反应物的接触面积,反应速率加快。
考点:本题考查电子排布式书写、原子半径比较、化学平衡影响元素等。

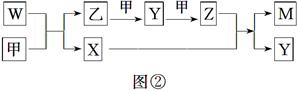
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
| B | D | |
| | | E |
请回答下列问题:
(1)Z的化学式为__________________。
(2)E的单质与水反应的离子方程式为________________________________________。
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W空气燃料电池放电时,正极反应式为________________________________,负极反应式为____________________。
(4)将一定量的A2、B2的混合气体放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡。测得平衡气体的总物质的量为0.50 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为________,该温度下的平衡常数为____________(结果保留3位有效数字)。
下表列出了A-R 9种元素在周期表中的位置
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
(1)填元素符号B D 。其中B、D的最高价氧化物对应的水化物的碱性最弱的是 (填化学式)。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠溶液反应的离子方程式是 。
(3)F元素氢化物的化学式是 ,该氢化物在常温下跟G元素形成的单质发生反应的化学方程式是 。
(4)G元素和H元素两者核电荷数之差是 。
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因: 。SiF4分子的空间构型为 ,SiF4中Si—F键间的键角 。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L? min。