��Ŀ����
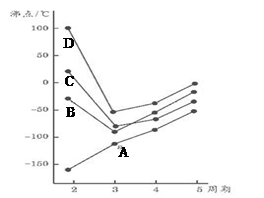
X��Y��Z��L��M��N������ԭ���������������ǰ������Ԫ�ء�X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ�M�ǵؿ��к�����ߵĽ���Ԫ�ء�N�ĺ˵������L�ĺ˵������3����2�� �ش��������⣺
��1��X��Y�����γ�10���ӡ�14���ӡ�18���ӷ��ӣ�д��XԪ������������������ȵĺ��صķ��� ����X��YԪ����ɵ�14���ӷ��ӵĵ���ʽΪ ��
��2����ˮ��Һ�� ��Fe3+��ԭΪFe2+��
��Fe3+��ԭΪFe2+�� +4Fe3+��4Fe2++�������л�ѧ��Ӧʽ�еIJ������ʼ������Ѹ������÷�Ӧ�����ӷ���ʽΪ______________________________��
+4Fe3+��4Fe2++�������л�ѧ��Ӧʽ�еIJ������ʼ������Ѹ������÷�Ӧ�����ӷ���ʽΪ______________________________��
��3��һ�������£�M��TiO2��C(ʯī)��Ӧֻ����M���������̼����(TiC)�����߾�ΪijЩ���½ṹ�մɵ���Ҫ�ɷ֡���֪���÷�Ӧ����lmol M��������ʱ�ų�536kJ�����������Ȼ�ѧ����ʽΪ ��
��4��ZԪ�ص���̬�⻯�������������Ӧ��ˮ���ﻯ������һ���Σ����ε�ˮ��Һ�� (��ᡱ��������С����ԣ���ˮ��Һ�и�����Ũ����С�����˳�� ��
��5��N�ĵͼ���������Һ��������Ʒ�Ӧ����N�ĵͼ���������������Ƶ����ʵ���֮��Ϊ2��1�������������ɣ���÷�Ӧ�����ӷ���ʽΪ ��
��1��12H H��C C��H��2�� N2H +4Fe3+��4Fe2++N2+5 H+
+4Fe3+��4Fe2++N2+5 H+
��3��4Al(s)+ 3TiO2(s)+3C(s) =" 2Al" 2O3(s)+ TiC(s) ��H= -1072kJ��mol-1
��4���� [OH-]<[H+]<[NH4+]<[NO ]
]
��5��3Na2O2 + 6 Fe2++6 H2O ="4" Fe(OH)3��+2 Fe3++6 Na+
�������������M�ǵؿ��к�����ߵĽ���Ԫ�أ�����M��Al��X��Y��Z��L����ɵ����ʵĻ���Ԫ�أ���X��Y��Z��L��M����Ԫ�ص�ԭ������������������X��Y��Z��L�ֱ���H��C��N��O��N�ĺ˵������L�ĺ˵������3����2��Ϊ������1��XԪ������������������ȵĺ��صķ���12H����X��YԪ����ɵ�14���ӷ��ӵĵ���ʽΪ H��C C��H��2����2����ˮ��Һ�� ��Fe3+��ԭΪFe2+��
��Fe3+��ԭΪFe2+�� +4Fe3+��4Fe2++����������ԭԭ����֪�÷�Ӧ�����ӷ���ʽΪ_ N2H
+4Fe3+��4Fe2++����������ԭԭ����֪�÷�Ӧ�����ӷ���ʽΪ_ N2H +4Fe3+��4Fe2++N2+5 H+����3������������Ȼ�ѧ����ʽ����д���輴Ϊ 4Al(s)+ 3TiO2(s)+3C(s) =" 2Al" 2O3(s)+ TiC(s) ��H= -1072kJ��mol-1 ����4���������ǿ��������ˮ������ԣ�����Ũ�ȴ�С��ϵΪ [OH-]<[H+]<[NH4+]<[NO
+4Fe3+��4Fe2++N2+5 H+����3������������Ȼ�ѧ����ʽ����д���輴Ϊ 4Al(s)+ 3TiO2(s)+3C(s) =" 2Al" 2O3(s)+ TiC(s) ��H= -1072kJ��mol-1 ����4���������ǿ��������ˮ������ԣ�����Ũ�ȴ�С��ϵΪ [OH-]<[H+]<[NH4+]<[NO ]��5����������������������������������ԭ��������������ԭ��Ӧԭ����д������ʽΪ3Na2O2 + 6 Fe2++6 H2O ="4" Fe(OH)3��+2 Fe3++6 Na+��
]��5����������������������������������ԭ��������������ԭ��Ӧԭ����д������ʽΪ3Na2O2 + 6 Fe2++6 H2O ="4" Fe(OH)3��+2 Fe3++6 Na+��
���㣺������һ������Ԫ�����ڱ���Ԫ��������֪ʶ���ۺ���Ŀ������Ƕȹ㣬�ѶȽϴ�

X��Y��Z��W��Ԫ�����ڱ���ǰ30��Ԫ�أ���ԭ���������������������Ϣ���±���
| Ԫ�� | �����Ϣ |
| X | Xԭ�ӻ�̬ʱ���������������ڲ����������2�� |
| Y | Y�Ļ�̬ԭ�����������Ų�ʽΪnsnnpn+2 |
| Z | ZԪ�ص���������븺�۴�����Ϊ6 |
| W | W��̬ԭ��δ�ɶԵ�������ǰ30��Ԫ�������� |
��1��Wλ��Ԫ�����ڱ��� ���ڵ� �壬���̬ԭ��������� �����ӡ�
��2��X�ĵ�һ�����ܱ�Y�� �����С������1mol X22-�к��е�
 ����ĿΪ ��
����ĿΪ ����3��X��Y����̬�⻯���У����ȶ����� ��д��ѧʽ��,Y��ͬ��Ԫ�أ�����Y��������⻯���зе���͵��� ��
��4��д��KZY3��HZŨ��Һ��Ӧ��ȡZ2�Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ ��
��5����֪��X(s)+Y2(g)=XY2(g) ��H 1= ��393.5 kJ?mol��1
XY(g) +1/2Y2(g)=XY2(g) ��H 2= ��282.9 kJ?mol��1
��X(s)��Y2(g)��Ӧ����XY(g)���Ȼ�ѧ��Ӧ����ʽΪ ��
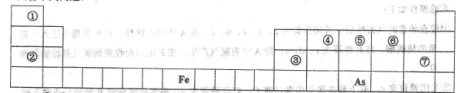
�±�ΪԪ�����ڱ���һ���֣������Ԫ�آ٣����ڱ��е�λ�ã�
�ش��������⣺
| �� ���� | IA | | 0 | |||||
| 1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
| 2 | | | | �� | �� | �� | | |
| 3 | �� | �� | �� | �� | | | �� | |
��1���ɢ١�������Ԫ����ɵ���Է�������Ϊ28���л���Ŀռ乹���� ��
����������ˮ�����ӳɷ�Ӧ�Ļ�ѧ����ʽ�� ��
��2���õ���ʽ��ʾ�ܵļ��⻯����γɹ������£� ��
��3�� �����ʵ��Ƚ�Ԫ�آ��������Ե����ǿ���� _��
��4�� �â�Ԫ�صĵ������Ԫ�صĵ��ʿ����Ƴɵ�أ������װ��KOHŨ��Һ������Ķ��Ե缫���ҽ���KOH��Һ�У��ڼ�ͨ��ٵĵ��ʣ��Ҽ�ͨ��ܵĵ��ʣ�����ĵ缫��ӦʽΪ�� ��
��5���ɱ��Т١��ۡ��ܡ��ޡ���Ԫ���γɵij�������X��Y��Z��M��N�ɷ������·�Ӧ��
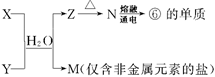
X��Һ��Y��Һ��Ӧ�����ӷ���ʽΪ ����ҵ�ϳ��õ��ʢ�ұ�����۵Ľ�����д���������͵��ʢ��ڸ����·�Ӧ�Ļ�ѧ����ʽ ��
X��Y��Z��W��Ԫ�����ڱ�ǰ�����ڳ���������Ԫ�أ�ԭ��������������X�ĵ��ʼ��ЦҼ��V�Цм�����X�ĵ�һ�����ܱ�������Ԫ�ض���Y�ĵ縺�Ա�X��С�����̬ԭ��������p�����Ǹò�s���ӵ�������Z��ǰ36��Ԫ����ԭ�Ӱ뾶��������Ԫ�أ�W��һ�ֺ��ص���������56����������30��
(1) Yλ��Ԫ�����ڱ���_______���ڵ�_______�壬W2+�ĺ�������Ų�ʽ��______��
(2) X��������XO2��H2O�Ƚϣ��۵�ϸߵ���_______ (�ѧʽ)��Z���⻯������ ���壬Z2O2�Ļ�ѧ��������_______(���ţ�
| A�����Ӽ� | B�����Թ��ۼ� | C���Ǽ��Թ��ۼ� | D�������� |
(4)��250C��101kPa�£�W�ĵ�����������ȼ�պ�ָ���ԭ�¶Ⱥ�ѹǿ��ƽ��ÿת��1mol���ӷų�QkJ����������W����ȼ�յ��Ȼ�ѧ����ʽ��_______��