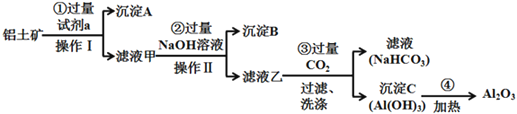
题目内容
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。图中横坐标表示加入NaOH溶液的体积,纵坐标表示生成沉淀的质量,有关说法正确的是( )
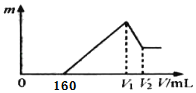
A.V1=400
B.金属粉末中含铝1.35 g
C.最后剩余沉淀质量5.8 g
D.无法确定V2的数值
【答案】A
【解析】
NaOH溶液的体积为0-160mL时,NaOH溶液用于中和反应剩余的硫酸,NaOH溶液的体积为160-V1mL时,NaOH溶液用于沉淀Mg2+和Al3+,NaOH溶液的体积为V1-V2mL时,NaOH溶液用于溶解所有的Al(OH)3沉淀,据此进行计算。
NaOH溶液的体积为0-160mL时,NaOH溶液用于中和反应剩余的硫酸,NaOH溶液的体积为160-V1mL时,NaOH溶液用于沉淀Mg2+和Al3+,NaOH溶液的体积为V1-V2mL时,NaOH溶液用于溶解所有的Al(OH)3沉淀,那么
A. 加入V1mLNaOH时,溶液中溶质为 Na2SO4,由硫酸根守恒n( Na2SO4)=n(H2SO4)=0.1L×2mol/L=0.2mol,由钠离子守恒n( NaOH)=2n( Na2SO4)=0.2mol×2=0.4mol,因此V1mL时消耗NaOH溶液体积为:![]() =0.4L=400mL, A项正确;
=0.4L=400mL, A项正确;
B. NaOH溶液的体积为160-V1mL时,NaOH溶液用于生成Mg(OH)2、Al(OH)3沉淀,根据电荷守恒可知,金属提供电子物质的量为(0.4L﹣0.16L)×1mol/L=0.24mol,设Mg、Al的物质的量分别为xmol、ymol,则:x+y=0.1,2x+3y=0.24,联立解得x=0.06,y=0.04,故Al的质量为0.04mol×27g/mol=1.08g,B项错误;
C. 最终剩余的沉淀为Mg(OH)2,结合Mg原子守恒可知,Mg(OH)2为0.06mol,其质量为0.06mol×58g/mol=3.48g,C项错误;
D. 由Al原子守恒可知Al(OH)3为0.04mol,由Al(OH)3+NaOH=NaAlO2+H2O可知,溶解Al(OH)3消耗NaOH为0.04mol,故需要NaOH溶液体积为![]() =0.04L=40mL,因此V2=240+40=280,D项错误;
=0.04L=40mL,因此V2=240+40=280,D项错误;
答案选A。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案