题目内容
【题目】用NaCl固体配制100mL2.0mol·L1NaCl溶液,请回答下列问题。
(1)用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和__。
(2)用托盘天平称取NaCl固体的质量是__g。
(3)下列情况中,会使所配溶液浓度偏高的是__(填字母)。
A.定容时,俯视刻度线 B.转移液体时,有少量液体洒出
C.加蒸馏水超过了刻度线 D.没有洗涤烧杯和玻璃棒
【答案】100mL容量瓶 11.7 A
【解析】
(1)配制100mL2.0mol·L1NaCl溶液需要100mL容量瓶,用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和100mL容量瓶;
(2)根据n=cV计算溶质的物质的量,再有m=nM计算溶质的质量;
(3)根据c=![]() 进行分析。
进行分析。
(1)配制100mL2.0mol·L1NaCl溶液需要100mL容量瓶,用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和100mL容量瓶;
故答案为:100mL容量瓶;
(2)配制100mL2.0mol·L1NaCl溶液,NaCl的物质的量=cV=0.1L×2.0mol·L1=0.2mol,则NaCl的质量=nM=0.2mol×58.5g/mol=11.7g,
故答案为:11.7;
(3)A. 定容时,俯视刻度线,使所配置溶液溶液体积偏小,溶液浓度偏高,故A符合题意;
B. 转移液体时,有少量液体洒出,使所配溶液溶质的物质的量减少,溶液浓度偏低,故B不符合题意;
C. 加蒸馏水超过了刻度线,使所配置溶液溶液体积偏大,溶液浓度偏低,故C不符合题意;
D. 没有洗涤烧杯和玻璃棒,使所配溶液溶质的物质的量减少,溶液浓度偏低,故D不符合题意;
故答案选A。

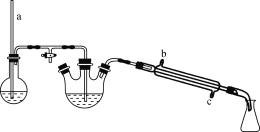
【题目】我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。如图为联合制碱法的主要过程(部分物质已略去)。
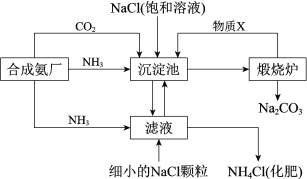
资料:ⅰ.沉淀池中的反应为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
ⅱ.溶解度
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
20°C溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)煅烧炉中反应的化学方程式是___,物质X是___(填化学式)。
(2)下列说法正确的是__(填字母)。
A.沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
(3)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是___。
(4)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为__。
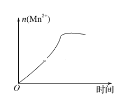
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
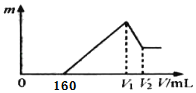
(1)其中V1=_____、T1=_____;通过实验_____(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=______。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_______。
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是_______。