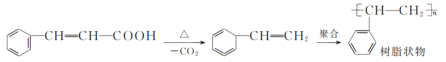
题目内容
【题目】电解锰工艺过程会产生锰、镁复盐,其组成为(NH4)7MnMg2(SO4)6.521H2O。一种综合利用该复盐的工艺流程如图所示:

已知:Ksp[Mg(OH)2]=1.8×10-11,Kb(NH3H2O)=1.8×10-5。回答下列问题:
(1)(NH4)7MnMg2(SO4)6.521H2O的水溶液呈__________________性(填“酸”或“碱”) ,Mn的化合价为__________________。
(2)“沉锰”的离子反应方程式为__________________;滤液1溶质的主要成分有__________________。
(3)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示:

①由图可知,“沉锰”合适的条件为__________________。
②Mg2+主要生成的是__________________沉淀(填“Mg(OH)2”或“MgCO3”),当温度高于45℃时Mg2+和Mn2+沉淀率的变化如图所示,原因是__________________。
(4)若将NH3通入0.01molL-1MgSO4溶液至Mg2+完全沉淀,则此时溶液中NH3H2O的物质的量浓度为__________________。(已知![]() =1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
=1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
【答案】酸 +2 HCO3-+NH3H2O+Mn2+=MnCO3↓+NH4++H2O (NH4)2SO4、MgSO4 pH=7.5、45℃ Mg(OH)2 当温度高于45℃,随着温度升高,NH4HCO3分解,c(CO32-)下降,所以Mn2+沉淀率下降,同时,随着温度升高,Mg2+水解生成Mg(OH)2程度增大,所以Mg2+沉淀率增大 ![]() molL-1≈1.5molL-1
molL-1≈1.5molL-1
【解析】
(NH4)7MnMg2(SO4)6.521H2O经溶解加热后,分解后逸出,加入氨水和碳酸氢铵将锰离子转化为碳酸锰沉淀,过滤后,得到滤液1 ,主要成分为(NH4)2SO4、MgSO4,加入氨水后得到沉淀氢氧化镁和滤液2 为(NH4)2SO4,碳酸锰沉淀加入硫酸后,得到硫酸锰。
(1)由于(NH4)7MnMg2(SO4)6.521H2O属于强酸弱碱盐,水溶液呈酸性,根据所有化合价之和等于0,设Mn的化合价为x,(+1)×7+x+(+2)×2+(-2)×6.5=0,计算出Mn的化合价为+2;
(2)“沉锰”是将锰离子转化为碳酸锰沉淀,离子反应方程式为HCO3-+NH3H2O+Mn2+=MnCO3↓+NH4++H2O;复盐溶液经沉锰后过滤得到的滤液1溶质的主要成分有(NH4)2SO4、MgSO4;
(3)①“沉锰”是为了让锰离子最大可能的沉淀,让镁离子不要沉淀,可以选择pH=7.5、45℃,这时锰离子的沉淀量最大,镁离子的沉淀量最小;
②Mg2+在碱性条件生成Mg(OH)2沉淀,当温度高于45℃,随着温度升高,NH4HCO3分解,c(CO32-)下降,所以Mn2+沉淀率下降;同时,随着温度升高,Mg2+水解生成Mg(OH)2程度增大.所以Mg2+沉淀率增大;
(4)Ksp[Mg(OH)2]=1.8×10-11, Ksp=c(Mg2+)c2(OH-),![]() (molL-1)2,由于2c (SO42-)= c (NH4+),0.01molL-1MgSO4溶液中,c(SO42-)=0.01molL-1, c(NH4+)=0.02molL-1,
(molL-1)2,由于2c (SO42-)= c (NH4+),0.01molL-1MgSO4溶液中,c(SO42-)=0.01molL-1, c(NH4+)=0.02molL-1, ![]() ,Kb(NH3H2O)=1.8×10-5,
,Kb(NH3H2O)=1.8×10-5,![]() ,
,![]()
![]() molL-1≈1.5molL-1。
molL-1≈1.5molL-1。

【题目】下列实验结论与实验操作及现象相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A. | 向某溶液中加入HCl 溶液,产生的气体使澄清的石灰水变浑浊 | 该溶液中含有CO32- |
B. | 向某溶液中通入Cl2,再加入KSCN溶液,溶液变红 | 该溶液中一定含有Fe2+ |
C. | 铁粉加入CuSO4溶液中,析出红色固体 | 氧化性:Fe2+ > Cu2+ |
D. | 向FeCl3溶液中滴加浓的维生素C溶液,黄色褪去 | 维生素C具有还原性 |
A.AB.BC.CD.D
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7