题目内容
【题目】对金属制品进行腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
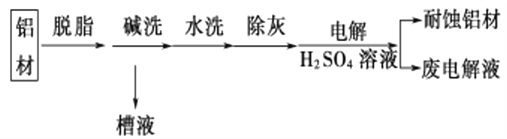
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是__________________(用离子方程式表示)。
为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________________________________________________________。
(3)利用如图装置,可以模拟铁的电化学防护。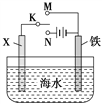
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
【答案】 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑ b 2Al+3H2O-6e-===Al2O3+6H+ 补充溶液中的Cu2+,保持溶液中Cu2+的浓度恒定 N 牺牲阳极保护法
【解析】(1)①铝材碱性可以洗去油污,同时也可以洗去表面的氧化铝,裸露的铝会和碱溶液反应放出氢气,2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑或2Al+2OH- +2H2O=2AlO2-+3H2↑,氢氧化铝是两性氢氧化物,可溶于强酸强碱,因此,溶液中的偏铝酸根,应通入CO2 使其沉淀成氢氧化铝,选b,②以铝材为阳极,在过量的H2SO4 溶液中电解,铝材表面形成氧化膜,铝失电子发生氧化反应,阳极电极反应式为2Al-6e-+3H2O=Al2O3 +6H+ ;(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是补充溶液中消耗的Cu2+ ,保持溶液中Cu2+ 浓度恒定;(3)若X为碳棒,为减缓铁的腐蚀,应构成电解池,阴极的电保护法,开关K应该置于N处,若X为锌,开光K置于M处,该电化学防护法称为牺牲阳极的阴极保护法。