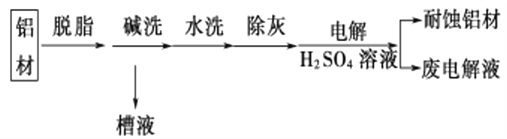
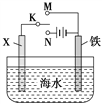
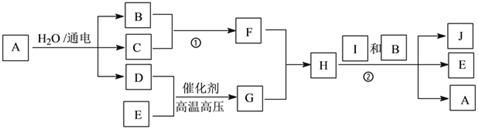
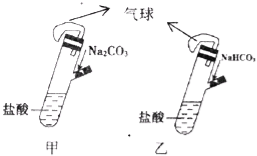
题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:B_________ C ________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是_______,碱性最强的是__________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是______,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点____(填"高"或"低"),原因_______________
(5)E元素原子的核电荷数是_________,E元素在周期表的第_______周期,第_____族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_____区。
【答案】 Na P N HNO3 NaOH F F 高 氨气分子间能形成氢键,而磷化氢分子中不存在分子间氢键。 26 第四周期 第VIII族 d区
【解析】A、B、C、D是四种短周期元素,由A的原子结构示意图可知x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素。
(1)由上述分析可知B为Na、C为P、D为N;(2)非金属性越强,最高价氧化物水化物的酸性越强,金属性越强,最高价氧化物水化物的碱性越强。则上述五种元素中最高价氧化物对应水化物酸性最强的是HNO3,碱性最强的是NaOH。(3)同周期自左向右,第一电离能逐渐增大(个别除外),所以第一电离能最大的元素是F,周期自左而右,电负性逐渐增大,故电负性最大的元素是F;(4)由于氨气分子间能形成氢键,而磷化氢分子中不存在分子间氢键,所以NH3比PH3的沸点高;(4)E为Fe元素,核电荷数是26,Fe在周期表中处于第四周期第Ⅷ族,位于周期表中的d区。

 阅读快车系列答案
阅读快车系列答案【题目】下列性质中,能说明乙醇宜作燃料的是( )
①燃烧时发生氧化还原反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A. ①②③④ B. ①②④ C. ①③④ D. ②③④
【题目】【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
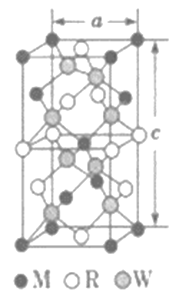
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
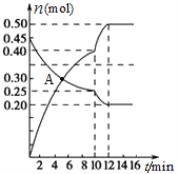
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温