题目内容
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P原子的核外电子排布图__________。
(2)NH3比PH3易液化的原因是_________。
(3)P4S3可用于制造火柴,其结构如图1所示。
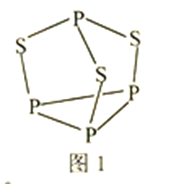
①P4S3中硫原子的杂化轨道类型为________。
②电负性:磷_____硫(填“>”或“<”);第一电离能磷大于硫的原因是________。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4中含有____mol配位键。
(5)NF3的键角小于NH3的键角,其原因是____________。
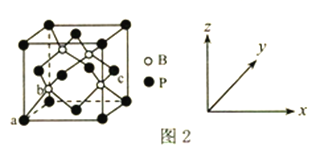
(6)磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a点和c点的原子坐标参数依次为(0,0,0)、(1,![]() ,
,![]() ),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
【答案】 ![]() NH3分子间存在氢鍵 sp3 < 磷原子3p轨道处于半满状态,不容易失去电子 2 F的电负性大于H,故NF3中N的周围的电子密度小于NH3中N周围电子密度
NH3分子间存在氢鍵 sp3 < 磷原子3p轨道处于半满状态,不容易失去电子 2 F的电负性大于H,故NF3中N的周围的电子密度小于NH3中N周围电子密度 ![]()
【解析】(1)P原子核电荷数为15,电子排布为1s22s22p63s23p3,核外电子排布图![]() ;正确答案:
;正确答案: ![]() 。
。
(2)NH3分子间存在氢鍵,PH3分子间无氢键,因此NH3比PH3易液化;正确答案:NH3分子间存在氢鍵。
(3)①P4S3中硫原子形成2个共价键,孤电子对数为1/2×(6-2×1)=2,则有4个价层电子对,其杂化的轨道类型为sp3;正确答案:sp3。
②同一周期,从左到右,电负性增大,因此电负性:磷<硫;同一周期,第一电离能呈现增大的趋势,由于磷原子3p轨道处于半满状态,不容易失去电子,第一电离能磷大于硫;正确答案: <;磷原子3p轨道处于半满状态,不容易失去电子。
(4)一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键;正确答案:2。
(5)F的电负性大于H,故NF3中N的周围的电子密度小于NH3中N周围电子密度,因此NF3的键角小于NH3的键角;正确答案:F的电负性大于H,故NF3中N的周围的电子密度小于NH3中N周围电子密度。
(6)图中a点坐标参数为(0、0、0)、c点坐标参数为(1、![]() 、
、![]() ),说明晶胞边长为1,a、c点距离为晶胞对角线的
),说明晶胞边长为1,a、c点距离为晶胞对角线的![]() ,则c点的原子坐标参数为(
,则c点的原子坐标参数为(![]() 、
、![]() 、
、![]() );根据晶胞结构可知:硼原子个数为4,磷原子个数为8×1/8+6×1/2=4,即该晶胞中含有4个磷化硼,质量为4×42/NAg, 设该晶胞的棱长为xcm,该晶胞中距离最近的两个磷原子的核间距离为面对角线上的一半,所以x=
);根据晶胞结构可知:硼原子个数为4,磷原子个数为8×1/8+6×1/2=4,即该晶胞中含有4个磷化硼,质量为4×42/NAg, 设该晶胞的棱长为xcm,该晶胞中距离最近的两个磷原子的核间距离为面对角线上的一半,所以x=![]() L×10-10cm,晶胞的体积为x3=(
L×10-10cm,晶胞的体积为x3=(![]() L)3×10-30 cm3;设晶胞的密度为ρg.cm-3,则ρ=[4×42/NA]÷[(
L)3×10-30 cm3;设晶胞的密度为ρg.cm-3,则ρ=[4×42/NA]÷[(![]() L)3×10-30] =
L)3×10-30] =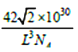 g.cm-3;正确答案:
g.cm-3;正确答案:![]() ;
;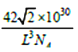 。
。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案