题目内容
【题目】如右图装置为某新型燃料电池的工作示意图,以HCl-NH4Cl溶液为电解质溶液。下列有关说法中正确的是( )

A. 通入H2的电极为正极
B. 该电池的负极反应式为:N2+6e-+8H+===2NH![]()
C. 图中分离出的A物质为NH4Cl
D. 该电池工作一段时间后,溶液的pH减小
【答案】C
【解析】A.氮气被还原生成NH4+,所以通入N2的一极为正极,通入H2的电极为负极,A错误;B.负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+,B错误;C.负极电极反应为:H2-2e-=2H+,正极电极反应N2+6e-+8H+=2NH4+,因此总反应式为N2+3H2+2H+=2NH4+,所以A为NH4Cl,C正确;D.根据总反应式为N2+3H2+2H+=2NH4+可知pH逐渐增大,D错误,答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】下列性质中,能说明乙醇宜作燃料的是( )
①燃烧时发生氧化还原反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A. ①②③④ B. ①②④ C. ①③④ D. ②③④
【题目】【题目】X、Y、Z、W、R、M六种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,相关信息如下:
元素 | 相关信息 |
X | 其单质为固体,常作电极材料 |
Y | 原子核外有6种不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(答题时,X、Y、Z、W、R、M用所对应的元素符号表示):
(1)X的单质与Z的单质反应的产物为_____________。(填化学式)。
(2)Z、W相比,第一电离能较大的是_____________,M2+的核外电子排布式为_____________。
(3)M2Z的熔点比M2W的_____________(填“高”或“低”),请解释原因______________________。
(4)Y和Z形成的化合物YZ2的VSEPR模型为__________,其中Y原子的杂化轨道类型为____________;N3-和YZ2互为等电子体,则N3-的结构式为_____________。
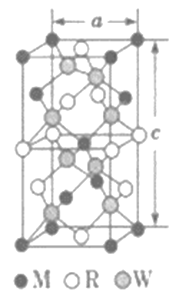
(5)MRW2的晶胞如图所示,晶胞参数a=0.524nm,c=1.032nm;MRW2的晶胞中每个M原子与_________个W原子相连,晶体密度ρ=________g·cm-3(只要求列算式,不必计算出数值,NA=6.02×1023mol-1)。