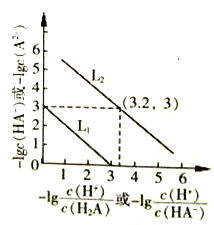
题目内容
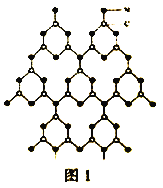
【题目】(1)福州大学王新晨教授以氨基氰(CH2N2)为原料制得类石墨相氮化碳(g-C3N4),其单层结构如图1。
①氨基氰CH2N2)分子中C、N原子均满足8电子稳定结构,则该分子的结构式为______;该分子为______(填“极性”或“非极性”)分子。
②氨基氰易溶于水或乙醇,其主要原因是_____________。
③关于g- C3N4的叙述正确的是_________。
A.电负性:C>N B.该物质的熔点比石墨更高
C.该物质属于原子晶体 D.该物质中C和N原子均采取SP2杂化
(2)NH3与Zn2+可形成[Zn(NH3)6]2+离子,部分结构如图2。

①NH3的空间构型为_________。
②[Zn(NH3)6]2+离子中存在的化学键类型有______;NH3分子中H-N-H键角为107.3°,判断[Zn(NH3)6]2+离子中H-N-H键角______107.3°(填">”、"<”或“=”)。
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有_______。(写一种)
(3)N元素形成的简单离子N3-与Xn+形成的晶体的是立方体结构,边长为anm,如图3所示。
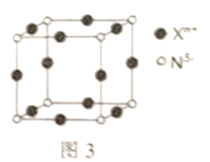
①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的价电子的轨道表示式为________。
②已知该晶体的密度为5.84g·cm-3,则阿伏加德罗常数NA的计算表示式为_____(含a)。
【答案】 ![]() 极性 ②氨基氰分子与水或乙醉分子间易形成氢键 BD 三角锥形 配位键、共价键 > CH3OH或CH3SH等
极性 ②氨基氰分子与水或乙醉分子间易形成氢键 BD 三角锥形 配位键、共价键 > CH3OH或CH3SH等 ![]()
![]() 或
或![]()
【解析】(1)①氨基氰CH2N2)分子中C、N原子均满足8电子稳定结构,该分子的结构式为![]() ;为极性分子;②氨基氰分子与水或乙醇分子间易形成氢键,故氨基氰易溶于水或乙醇;③A.非金属性越强元素的电负性越强,则电负性: N > C,选项A错误;B.碳氮键键长短于碳碳键,形成共价键的键能越高,故g- C3N4的熔点比石墨更高,选项B正确;C.该物质属于分子晶体,选项C错误; D.该物质中C、N原子两两相连且成环,C和N原子均采取SP2杂化,选项D正确。答案选BD;(2)①NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,分子空间构型是三角锥形;②[Zn(NH3)6]2+离子中存在的化学键类型有配位键、共价键;受配位键的影响, [Zn(NH3)6]2+离子中H-N-H键角>107.3°;③等电子体是指原子数相同、价电子数相同、具有相似结构的分子、离子、或离子团。与N2H4互为等电子体的分子有CH3OH或CH3SH等;(3)①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的核外电子排布式为1s22s22p63s23p63d104s2,其价电子的轨道表示式为
;为极性分子;②氨基氰分子与水或乙醇分子间易形成氢键,故氨基氰易溶于水或乙醇;③A.非金属性越强元素的电负性越强,则电负性: N > C,选项A错误;B.碳氮键键长短于碳碳键,形成共价键的键能越高,故g- C3N4的熔点比石墨更高,选项B正确;C.该物质属于分子晶体,选项C错误; D.该物质中C、N原子两两相连且成环,C和N原子均采取SP2杂化,选项D正确。答案选BD;(2)①NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,分子空间构型是三角锥形;②[Zn(NH3)6]2+离子中存在的化学键类型有配位键、共价键;受配位键的影响, [Zn(NH3)6]2+离子中H-N-H键角>107.3°;③等电子体是指原子数相同、价电子数相同、具有相似结构的分子、离子、或离子团。与N2H4互为等电子体的分子有CH3OH或CH3SH等;(3)①Xn+中所有的电子恰好充满K、L、M三个电子层,则基态X原子的核外电子排布式为1s22s22p63s23p63d104s2,其价电子的轨道表示式为![]() ;②根据图3知,每个晶胞中含有N3-8
;②根据图3知,每个晶胞中含有N3-8![]() 个,Xn+12
个,Xn+12![]() 个,边长为anm=a
个,边长为anm=a![]() ,体积为
,体积为![]() ,已知该晶体的密度为5.84g·cm-3,5.84g·cm-3=
,已知该晶体的密度为5.84g·cm-3,5.84g·cm-3= 则阿伏加德罗常数NA的计算表示式为
则阿伏加德罗常数NA的计算表示式为![]() 。
。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
请回答下列问题:
(1)①中所得混合溶液c(OH-)=______ mol·L-1。
(2)②中,c______0.2(填“>”“<”或“=”)。
(3)③中所得混合溶液,各离子浓度由大到小的顺序是_______。
(4)①、③所用氨水中的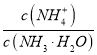 :①_______③(填“>”“<”或“=”)。
:①_______③(填“>”“<”或“=”)。
【题目】为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×1017 ,Ksp (AgSCN,白色 )= 1.0×1012 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。