题目内容
【题目】现有Fe、FeO、Fe2O3和Fe3O4组成的混合物,取一定质量,加入100 mL 4 mol/L的盐酸,混合物恰好完全溶解,放出a mL(标准状况下)的气体,所得溶液中加入KSCN溶液无血红色出现。若取等质量的该混合物,用足量的CO还原可得铁单质的质量为
A.2.8g B.5.6g C. 8.4g D.11.2 g
【答案】D
【解析】
试题分析:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)= ![]() n(HCl)=
n(HCl)= ![]() ×0.1L×4mol/L=0.2mol。用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.2mol,质量为0.2mol×56g/mol=11.2g,
×0.1L×4mol/L=0.2mol。用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.2mol,质量为0.2mol×56g/mol=11.2g,

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
【题目】常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
请回答下列问题:
(1)①中所得混合溶液c(OH-)=______ mol·L-1。
(2)②中,c______0.2(填“>”“<”或“=”)。
(3)③中所得混合溶液,各离子浓度由大到小的顺序是_______。
(4)①、③所用氨水中的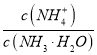 :①_______③(填“>”“<”或“=”)。
:①_______③(填“>”“<”或“=”)。