题目内容
A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,其中A、B、C为短周期非金属元素.A是形成化合物种类最多的元素;B原子基态电子排布中只有一个未成对电子;C是同周期元素中原子半径最小的元素.D的基态原子在前四周期元素的基态原子中单电子数最多;E 与D相邻,E的某种氧化物X与C的氢化物的浓溶液加热时反应常用于实验室制取气态单质C;F与D的最外层电子数相等.回答下列问题(相关回答均用元素符号表示):
(1)D的基态原子的核外电子排布式是 .
(2)B的氢化物的沸点比C氢化物的沸点 (填“高”或“低”),原因是 .
(3)A的电负性 C的电负性(填“大于”或“小于”),A形成的氢化物A2H4中A的杂化类型是 .
(4)X在制取C单质中的作用是 ,C的某种含氧酸盐常用于实验室中制取氧气,此酸根离子中化学键的键角 109°28′(填“>”、“=”或“<”).
(5)已知F与C的某种化合物的晶胞结构如图所示,则该化合物的化学式是 ,若F与C原子最近的距离为a cm,则该晶体的密度为 g?cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA ).
(1)D的基态原子的核外电子排布式是
(2)B的氢化物的沸点比C氢化物的沸点
(3)A的电负性
(4)X在制取C单质中的作用是

(5)已知F与C的某种化合物的晶胞结构如图所示,则该化合物的化学式是
分析:A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,其中A、B、C为短周期非金属元素.A是形成化合物种类最多的元素,则A为碳元素;B原子基态电子排布中只有一个未成对电子,外围电子排布为ns2np1或ns2np5,结合原子序数且B为非金属性元素,可推知外围电子排布为ns2np5,C是同周期元素中原子半径最小的元素,处于ⅦA族,可推知B为F元素、C为Cl元素;D的基态原子在前四周期元素的基态原子中单电子数最多,其原子外围电子排布式为1s22s22p63s23p63d54s1,则D为Cr;E与D相邻,E的某种氧化物X与HCl的浓溶液加热时反应常用于实验室制取气态单质Cl2,则E为Mn、X为MnO2;F与D的最外层电子数相等,最外层电子排布为ns1,原子序数大于Cr,则F为Cu,据此解答.
解答:解:A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,其中A、B、C为短周期非金属元素.A是形成化合物种类最多的元素,则A为碳元素;B原子基态电子排布中只有一个未成对电子,外围电子排布为ns2np1或ns2np5,结合原子序数且B为非金属性元素,可推知外围电子排布为ns2np5,C是同周期元素中原子半径最小的元素,处于ⅦA族,可推知B为F元素、C为Cl元素;D的基态原子在前四周期元素的基态原子中单电子数最多,其原子外围电子排布式为1s22s22p63s23p63d54s1,则D为Cr;E与D相邻,E的某种氧化物X与HCl的浓溶液加热时反应常用于实验室制取气态单质Cl2,则E为Mn、X为MnO2;F与D的最外层电子数相等,最外层电子排布为ns1,原子序数大于Cr,则F为Cu,
(1)D的基态原子在前四周期元素的基态原子中单电子数最多,其核外电子排布式:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(2)HF分子间能形成氢键,故其沸点比较HCl高,故答案为:高;HF分子间能形成氢键;
(3)同周期自左而右电负性增大,故电负性C<F,C2H4中C原子成2个C-H、1个C=C双键,不含孤对电子,C原子采取sp2杂化,故答案为:小于;sp2;
(4)MnO2在制取Cl2单质中的作用是氧化剂,C的某种含氧酸盐常用于实验室中制取氧气,此酸根离子为ClO3-,Cl原子价层电子对数=3+
=4,含有1对孤对电子,为三角锥形,故化学键的键角<109°28′,
故答案为:氧化剂;<;
(5)由晶胞结构可知,晶胞中黑色球数目=4、白色球数目=8×
+6×
=4,故该化合物的化学式是CuCl,晶胞的质量=4×
g,晶胞中黑色球与周围的4个白色球形成正四面体结构,若Cu与Cl原子最近的距离为a cm,如图正四面体: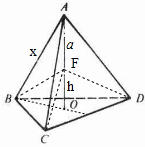 ,连接F与A、B、C、D,则三棱锥A-BCD均分为等4个等体积的三棱椎,则V三棱锥A-BCD=4V三棱锥F-BCD=,故
,连接F与A、B、C、D,则三棱锥A-BCD均分为等4个等体积的三棱椎,则V三棱锥A-BCD=4V三棱锥F-BCD=,故
S△BCD?(a+h)=4×
S△BCD?h,故h=
a,令正四面体的棱长为x cm,连接AF并延长交三角形BCD与O,O为正三角形BCD的中心,BO垂直平分CD,则BO的长度=x cm×
×
=
cm,在直角三角形BOF中,(
)2+(
a)2=a2,解得x=
,故晶胞的棱长=
×2x cm=
×2×
cm=
cm,故晶胞的体积=(
cm)3=
a3 cm3,则晶胞密度=
=
g?cm-3,
故答案为:
.
(1)D的基态原子在前四周期元素的基态原子中单电子数最多,其核外电子排布式:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(2)HF分子间能形成氢键,故其沸点比较HCl高,故答案为:高;HF分子间能形成氢键;
(3)同周期自左而右电负性增大,故电负性C<F,C2H4中C原子成2个C-H、1个C=C双键,不含孤对电子,C原子采取sp2杂化,故答案为:小于;sp2;
(4)MnO2在制取Cl2单质中的作用是氧化剂,C的某种含氧酸盐常用于实验室中制取氧气,此酸根离子为ClO3-,Cl原子价层电子对数=3+
| 7+1-2×3 |
| 2 |
故答案为:氧化剂;<;
(5)由晶胞结构可知,晶胞中黑色球数目=4、白色球数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 99.5 |
| NA |
 ,连接F与A、B、C、D,则三棱锥A-BCD均分为等4个等体积的三棱椎,则V三棱锥A-BCD=4V三棱锥F-BCD=,故
,连接F与A、B、C、D,则三棱锥A-BCD均分为等4个等体积的三棱椎,则V三棱锥A-BCD=4V三棱锥F-BCD=,故| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 2 |
| 3 |
| ||
| 3 |
| ||
| 3 |
| 1 |
| 3 |
2
| ||
| 3 |
| ||
| 2 |
| ||
| 2 |
2
| ||
| 3 |
4
| ||
| 3 |
4
| ||
| 3 |
| 64 | ||
3
|
4×
| ||||
|
99.5×3
| ||
| 16a3NA |
故答案为:
99.5×3
| ||
| 16a3NA |
点评:本题考查物质结构与性质,推断元素是解题的关键,(5)中晶胞计算为易错点、难点,需要学生具备一定的数学计算能力,难点较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.