题目内容
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )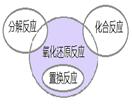
| A.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
B.4NH3 +5O2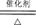 4NO+6H2O 4NO+6H2O |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl+Br2 |
B
解析试题分析:由关系图可知,阴影部分是氧化还原反应,但是不属于分解反应、置换反应和化合反应,所以只有B正确。
考点:氧化还原反应与四种基本反应类型的关系。

练习册系列答案
相关题目
三氟化氮是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3+5H2O=2NO+HNO3+9HF。下了有关该反应的说法正确的是:
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2:1 |
| C.若生成0.2mol HNO3,则转移0.2mol电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
有一混合溶液,其中只含有Fe2+、Cl﹣、Br﹣、I﹣(忽略水的电离),Cl﹣、Br﹣、I﹣的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl﹣和Br﹣的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
| A.7:4 | B.7:3 | C.7:2 | D.7:1 |
下列褪色过程不是因为氧化还原反应而褪色的是( )
| A.SO2气体通入到溴水中使溴水褪色 |
| B.氯水使滴有酚酞的NaOH溶液褪色,再加入NaOH后不变红 |
| C.SO2气体能使品红溶液褪色 |
| D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:
2Fe(OH)3+3Cl2+10KOH2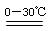 K2FeO4+KCl+8H2O
K2FeO4+KCl+8H2O
对于该反应,下列说法正确的是
| A.该反应是置换反应 | B.钾元素化合价降低 |
| C.Fe(OH)3发生还原反应 | D.Cl2是氧化剂 |
过氧化氢(O为—1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2 + H2O2 + 2H+ = Mn2+ + O2↑ + 2H2O ②Mn2+ + H2O2 = MnO2 + 2H+
下列说法正确的是( )
| A.H2O2在①中是氧化剂,在②中是还原剂 |
| B.在①中每生成1 mol O2,转移的电子数为1.204×1024 |
| C.Mn2+在①中是还原产物,在②中是氧化产物 |
| D.在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2 |
下列转化,需要加入氧化剂才能完成的是
| A.H+ →H2 | B.MnO4-→Mn2+ | C.CO2→CO32- | D.S2-→SO42- |
实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O
在这一过程中,每制取l mol I2时,所消耗氧化剂的质量是( )
| A.28g | B.16g | C.329 | D.46g |
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
( )
| A.1∶1∶2 | B.2∶1∶3 | C.6∶3∶2 | D.3∶2∶1 |