题目内容
下列转化,需要加入氧化剂才能完成的是
| A.H+ →H2 | B.MnO4-→Mn2+ | C.CO2→CO32- | D.S2-→SO42- |
解析试题分析:物质中所含元素化合价升高,则该物质被氧化时,需加入氧化剂才能实现,D中硫元素化合价升高,故选D。
考点:氧化还原反应

练习册系列答案
相关题目
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3 +3F2=NF3 +3NH4F,它在潮湿的环境中能发生反应:
3 NF3+5H2O=2NO+HNO3+9HF。下列说法正确的是( )
| A.制取NF3的反应中,氧化剂与还原剂的物质的量之比为1:3 |
| B.NF3在潮湿的空气中泄漏会产生红棕色气体 |
| C.若在制取NF3的反应中有2molNH3参加反应,转移电子的物质的量为12mol |
| D.它在潮湿的环境中NF3是氧化剂,H2O是还原剂 |
已知M2O7x-与S2-在酸性溶液中能发生反应:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则
M2O7x-中M元素的化合价是( )
| A.+2 | B.+3 | C.+4 | D.+6 |
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )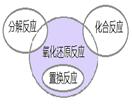
| A.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
B.4NH3 +5O2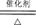 4NO+6H2O 4NO+6H2O |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl+Br2 |
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e-→ SO42- + 4H+; (2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯 气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为( )
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是
| A.Na2S | B.S | C.SO2 | D.H2SO4 |
根据下列反应判断氧化剂的氧化性由强到弱的顺序,正确的是
①Cl2+2KI=I2+2KCl ②2FeCl3+2HI=I2+2FeCl2+2HCl
③2FeCl2+Cl2=2FeCl3 ④I2+SO2+2H2O=2HI+H2SO4
| A.Cl2>I2>Fe3+>SO24- | B.Cl2>Fe3+>I2>SO24- |
| C.Fe3+>Cl2>I2>SO24- | D.Cl2>Fe3+>SO24->I2 |
在3NO2+H2O=2HNO3+NO中,氧化剂与还原剂的分子个数比为
| A.2∶1 | B.1∶2 | C.3∶1 | D.1∶3 |
