题目内容
实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O
在这一过程中,每制取l mol I2时,所消耗氧化剂的质量是( )
| A.28g | B.16g | C.329 | D.46g |
B
解析试题分析: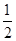 O2
O2 NO2
NO2 I2
I2
0.5mol 1mol
0.5mol的氧气的质量为16克,选B
考点:电子守恒。

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
关于3Cl2 + 6KOH  KClO3 + 5KCl + 3H2O反应,以下说法正确的是 ( )
KClO3 + 5KCl + 3H2O反应,以下说法正确的是 ( )
| A.Cl2是氧化剂,KOH是还原剂 |
| B.被氧化的氯元素的质量为被还原的氯元素质量的5倍 |
| C.3mol氯气参加反应转移10mol电子 |
| D.KOH既不是氧化剂,又不是还原剂 |
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )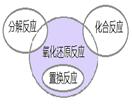
| A.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
B.4NH3 +5O2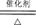 4NO+6H2O 4NO+6H2O |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl+Br2 |
从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是
| A.Na2S | B.S | C.SO2 | D.H2SO4 |
根据下列反应判断氧化剂的氧化性由强到弱的顺序,正确的是
①Cl2+2KI=I2+2KCl ②2FeCl3+2HI=I2+2FeCl2+2HCl
③2FeCl2+Cl2=2FeCl3 ④I2+SO2+2H2O=2HI+H2SO4
| A.Cl2>I2>Fe3+>SO24- | B.Cl2>Fe3+>I2>SO24- |
| C.Fe3+>Cl2>I2>SO24- | D.Cl2>Fe3+>SO24->I2 |
已知反应①2BrO3-+ Cl2=Br2 +2ClO3- ;②5Cl2 + I2 +6H2O=2HIO3 +10HCl ③ClO3-+5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是
| A.ClO3->BrO3->IO3->Cl2 | B.BrO3- >Cl2>C1O3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->C1O3->IO3- |
在3NO2+H2O=2HNO3+NO中,氧化剂与还原剂的分子个数比为
| A.2∶1 | B.1∶2 | C.3∶1 | D.1∶3 |
氰化物有剧毒,在碱性条件下可用如下方法进行处理:
2CN-+120H-+5Cl2=2CO32-+N2+10Cl-+6H20,则下列判断中,不正确的是
| A.上述反应中的氧化剂是Cl2 |
| B.该反应过程中只有氮元素被氧化 |
| C.还原性:CN-> Cl- |
| D.当有1 molCl2参加反应时,转移的电子数为2mol |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是
| A.Cl2+2KBr |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O |
| D.2Na2O2+2CO2 |