题目内容
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
( )
| A.1∶1∶2 | B.2∶1∶3 | C.6∶3∶2 | D.3∶2∶1 |
C
解析试题分析:因为消耗的氯气的体积相等,因此在反应中得到的电子的物质的量是相等的,那么作为还原剂的这三种物质,在反应中所失去的电子数也是相等的,1 mol KI在转变成单质时,失去1 mol的电子,、1 mol Na2S被氧化时,失去2 mol电子,1 mol FeBr2被氧化时,失去3mol电子,因为在反应中氯气所得到的电子相等,所以消耗的KI、Na2S、FeBr2溶分别是6 mol、3mol、2 mol,又因为在同一溶液中,所以KI、Na2S、FeBr2溶液的物质的量浓度之比是6∶3∶2。选C。
考点:考查氧化还原的电子守恒。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是( )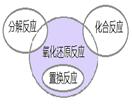
| A.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
B.4NH3 +5O2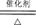 4NO+6H2O 4NO+6H2O |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl+Br2 |
在3NO2+H2O=2HNO3+NO中,氧化剂与还原剂的分子个数比为
| A.2∶1 | B.1∶2 | C.3∶1 | D.1∶3 |
氰化物有剧毒,在碱性条件下可用如下方法进行处理:
2CN-+120H-+5Cl2=2CO32-+N2+10Cl-+6H20,则下列判断中,不正确的是
| A.上述反应中的氧化剂是Cl2 |
| B.该反应过程中只有氮元素被氧化 |
| C.还原性:CN-> Cl- |
| D.当有1 molCl2参加反应时,转移的电子数为2mol |
Cl2、Br2、I2都具有氧化性。向NaBr、NaI的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是( )
| A.NaCl | B.NaCl、NaBr | C.NaCl、NaBr、NaI | D.NaCl、NaI |
下列关于氧化还原反应说法正确的是
| A.肯定有一种元素被氧化,另一种元素被还原 |
| B.在反应中不一定所有元素的化合价都发生变化 |
| C.某元素从化合态变成单质,该元素一定被还原 |
| D.在氧化还原反应中非金属单质一定是氧化剂 |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是
| A.Cl2+2KBr |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O |
| D.2Na2O2+2CO2 |
向1mol炽热的Cu2S通人足量的水蒸气,充分反应后生成2mol H2,则Cu2S应转化为
| A.Cu和SO2 | B.Cu和S | C.CuO和SO2 | D.Cu2O和S |
