题目内容
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这四种金属的活动性顺序是
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
| 实验装置 | 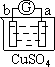 | 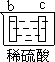 | 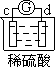 | 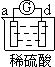 |
| 部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
C
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。a极质量减小,b极质量增加,这说明a电极是负极,失去电子,b电极是正极,溶液中的铜离子得到电子,则金属性是a>b。b电极有气体产生,c极无变化,这说明b的金属性强于c的;d极溶解,c极有气体产生,这说明d电极是负极,c电极是正极,溶液中的氢离子放电,生成氢气,则金属性是d>c;电流计指示在导线中电流从a极流向d极,这说明d电极是负极,a电极是正极,则金属性是d>a,所以这四种金属的活动性顺序是d>a>b>c,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。主要是考查对原电池原理,以及灵活运用原电池判断金属性强弱的熟悉了解程度,旨在培养学生分析、归纳和总结问题的能力。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可。

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
 ,
,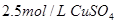 溶液,如有
溶液,如有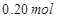 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题: 的质量是 ,得到
的质量是 ,得到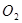 的体积(标准状况)是 。
的体积(标准状况)是 。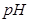 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)