题目内容
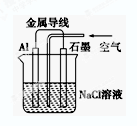
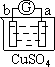
X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快;X与Y组成原电池时,Y电极质量减少,X,Y,Z三种金属的活动性顺序为:
| A.X>Y>Z | B.X>Z>Y | C.Y>X>Z | D.Y>Z>X |
C
试题分析:X,Y,Z都是金属,在X与稀H2SO4反应中,加入少量Z的硫酸盐溶液时能使反应加快。这说明反应中X能置换出Z,构成原电池,加快反应速率,因此金属性是X强于Z。X与Y组成原电池时,Y电极质量减少,这说明在该原电池中X是正极,Y是负极,失去电子,质量减少,所以金属性是Y强于X,则X,Y,Z三种金属的活动性顺序为Y>X>Z,答案选C。

练习册系列答案
相关题目
 CaS+4CO↑
CaS+4CO↑