题目内容
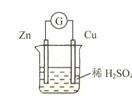
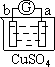
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题:
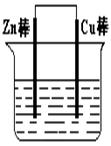
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒的所产生现象是 ,写出该电极反应式: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应,Zn棒上发生反应的电极反应式为: 。

(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒的所产生现象是 ,写出该电极反应式: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应,Zn棒上发生反应的电极反应式为: 。
(10分)(1)负极(2分)有气泡生成(或有气体放出)(2分);2H++2e-=H2↑(2分)
(2)还原 (2分) Zn-2e-=Zn2+ (2分)
(2)还原 (2分) Zn-2e-=Zn2+ (2分)
试题分析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌失去电子,做负极。铜是正极,溶液中的氢离子在正极得到电子,生成氢气,电极反应式是2H++2e-=H2↑,所以实验现象是有气泡生成(或有气体放出)。
(2)若电解质为硫酸铜溶液,则溶液中的铜离子在正极得到电子,发生还原反应。而锌仍然是负极,失去电子,电极反应式是Zn-2e-=Zn2+。
点评:该题是中等难度的试题,也是高考中的常见题型,属于基础性试题的考查。试题贴近教材,基础性强,有利于激发学生的学习兴趣和学习积极性。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和规范的答题能力。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
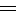 Zn2++Cu,该反应的原电池组成正确的是
Zn2++Cu,该反应的原电池组成正确的是