题目内容
在25℃时,用石墨电极电解 ,
,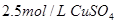 溶液,如有
溶液,如有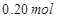 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题:
(1)阴极发生 反应,电极反应为 。
(2)阳极发生 反应,电极反应为 。
(3)电解后得到的 的质量是 ,得到
的质量是 ,得到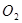 的体积(标准状况)是 。
的体积(标准状况)是 。
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的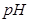 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)
 ,
,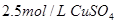 溶液,如有
溶液,如有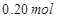 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题:(1)阴极发生 反应,电极反应为 。
(2)阳极发生 反应,电极反应为 。
(3)电解后得到的
 的质量是 ,得到
的质量是 ,得到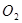 的体积(标准状况)是 。
的体积(标准状况)是 。(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的
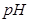 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)(1)还原 Cu2++2e-=Cu (2)氧化 4OH--4e-=2H2O+O2↑
(3)6.4g 1.12L (4)12.8g 不变
(3)6.4g 1.12L (4)12.8g 不变
试题分析:(1)惰性电极电解硫酸铜溶液,阴极发生还原反应,则溶液中的铜离子在阴极得到电子而析出,电极反应式是Cu2++2e-=Cu。
(2)惰性电极电解硫酸铜溶液,阳极失去电子,发生氧化反应。则溶液中的OH-放电生成氧气,电极反应式是4OH--4e-=2H2O+O2↑。
(3)反应中注意0.20mol电子,则根据反应式Cu2++2e-=Cu可知,析出0.10mol铜,质量是6.4g。根据反应式4OH--4e-=2H2O+O2↑可知,生成氧气的物质的量是0.05mol,标准状况下的体积是0.05mol×22.4L/mol=1.12L。
(4)如用等质量的两块铜片代替石墨作电极,则阳极是铜失去电子,质量减少6.4g。阴极是溶液中的铜离子得到电子,析出6.4g铜,所以电解后两铜片的质量相差12.8g,而溶液中的浓度不变,则pH不变。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确电解池的工作原理,并依据电子得失守恒计算,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和规范的答题能力。

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
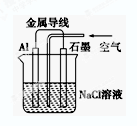
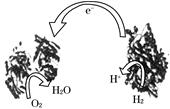
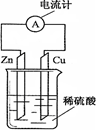
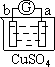
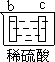
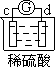
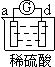
 Zn2++Cu,该反应的原电池组成正确的是
Zn2++Cu,该反应的原电池组成正确的是