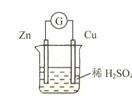
题目内容
利用Cu+ 2FeCl3=CuCl2+ 2FeCl2反应,设计一个原电池。
(1)写出电极反应式:负极 。
正极 。
(2)在下面的烧杯中画出装置图,并作必要的标注:
(1)写出电极反应式:负极 。
正极 。
(2)在下面的烧杯中画出装置图,并作必要的标注:

(8分)(1)Cu-2e-=Cu2+ (2分) ;2Fe3+ + 2e==2Fe2+ (2分)
(2)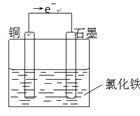 (4分)
(4分)
(2)
 (4分)
(4分)试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,铜失去电子,是还原剂,做负极,电极反应式是Cu-2e-=Cu2+。正极材料是金属性弱于铜的金属或石墨,而电解质溶液可以是氯化铁,正极电极反应式 2Fe3+ + 2e==2Fe2+,装置图如下
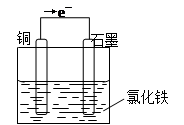 。
。点评:该题是基础性试题的考查,难度不大。该题的关键是明确原电池的构造原理,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和规范答题能力。

练习册系列答案
相关题目

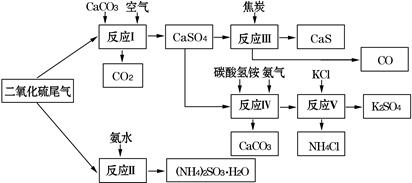
 CaS+4CO↑
CaS+4CO↑ 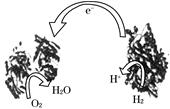
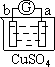
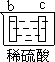
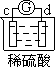
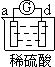
 Zn2++Cu,该反应的原电池组成正确的是
Zn2++Cu,该反应的原电池组成正确的是