题目内容
【题目】Ca(NO2)2(亚硝酸钙)是易溶于水的无色晶体,可用作混凝土中钢筋的防护剂。
(1)Ca(NO2)2的制备方法很多。
①实验室可用反应Ca(NO3)2+2CaFe2O4+4NO![]() 3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
3Ca(NO2)2+2Fe2O3制备Ca(NO2)2,该反应中被氧化的N原子与被还原的N原子的物质的量之比为_____。
②用石灰乳吸收硝酸工业尾气中氮氧化物制备Ca(NO2)2,其中NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2的化学方程式为_____,经过滤得到含Ca(NO2)2的溶液为液态产品。
(2)测定某液态产品中NO3-含量的步骤如下:
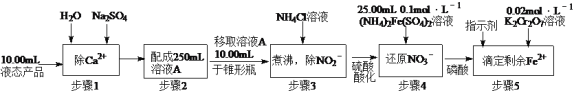
已知:步骤4中的反应为NO3—+3Fe2++4H+=3Fe3++NO↑+2H2O,
步骤5中的反应为6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O。
若步骤5滴定至终点时消耗K2Cr2O7溶液20.00mL,计算液态产品中NO3-的含量(单位g·L-1,最后结果保留一位小数,写出计算过程)___________。
【答案】2∶1 4NO2 + 2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O 与K2Cr2O7反应的n(Fe2+)=6n(K2Cr2O7)=6×0.0200mol·L-1×20.00mL×10-3L·mL-1=2.400×10-3mol,与NO3-反应的n(Fe2+)=0.1000 mol·L-1×25.00mL×10-3L·mL-1-2.400×10-3mol=1.000×10-4mol,NO3-的含量为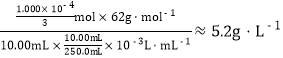
【解析】
(1)①Ca(NO3)2中N为+5价,NO中N为+2价,Ca(NO2)2中N为+3价,即Ca(NO3)2为氧化剂,NO为还原剂,被氧化的N原子与被还原的N原子的物质的量为之比为4:2=2:1;
②NO2与Ca(OH)2反应生成Ca(NO2)2和Ca(NO3)2,即该反应方程式为NO2+Ca(OH)2→Ca(NO3)2+Ca(NO2)2+H2O,NO2在该反应既是氧化剂又是还原剂,利用化合价升降法进行配平,即4NO2 + 2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O;
(2)与K2Cr2O7反应的n(Fe2+)=6n(K2Cr2O7)=6×0.0200mol·L-1×20.00mL×10-3L·mL-1=2.400×10-3mol,与NO3-反应的n(Fe2+)=0.1000 mol·L-1×25.00mL×10-3L·mL-1-2.400×10-3mol=1.000×10-4mol,则原溶液中m(NO3-)=1.000×10-4mol×62g·mol-1×250mL/(3×10mL),根据流程液态产品的体积为10.00×10-3L,即NO3-的含量为5.2g·L-1;

 名校课堂系列答案
名校课堂系列答案【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
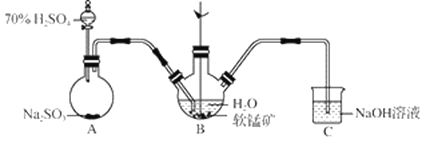
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
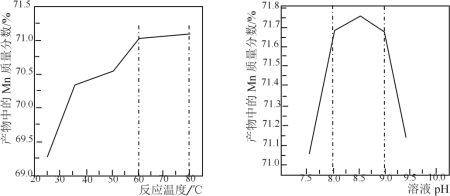
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。