题目内容
【题目】下列说法正确的是( )
A.相同条件下,N2和O3混合气体与等体积的N2所含的原子数相同
B.等物质的量的CH5+和OH-所含电子数相等
C.常温常压下,28gCO与22.4LO2所含分子数相等
D.16gCH4与18gNH4+所含质子数相等
【答案】B
【解析】
A. 相同条件下,由于氮气是双原子分子,臭氧是三原子分子,因此N2和O3混合气体与等体积的N2所含的原子数不相同,故A错误;
B. 1个CH5+含有10个电子,1个OH-含有10个电子,因此等物质的量的CH5+和OH-所含电子数相等,故B正确;
C. 28gCO物质的量为1mol,常温常压下,气体摩尔体积为24.5 L·mol1,因此22.4LO2常温常压下物质的量小于1mol,因此所含分子数不相等,故C错误;
D. 16gCH4物质的量![]() ,质子数为10NA,18gNH4+物质的量
,质子数为10NA,18gNH4+物质的量![]() ,质子数为11NA,因此所含质子数不相等,故D错误;
,质子数为11NA,因此所含质子数不相等,故D错误;
综上所述,答案为B。

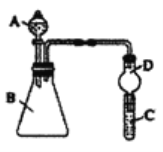
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
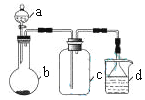
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
【题目】元素周期表中的四种元素的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
长周期元素 | Z | Z的一种盐乙可以作净水剂,Z的某种氧化物丙可以做红色涂料 |
W | W元素大多存在于海藻种,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为___,X、Y、Z三种元素的简单离子半径从大到小的顺序为___。
(2)足量W的最高价氧化物的水化物是稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式:____。
(3)下列有关W的气态氢化物丁的说法正确的有___(选填字母)
a.丁比氯化氢沸点高 b.丁比氯化氢稳定性好
c.丁比氟化氢还原性弱 d.丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式___。