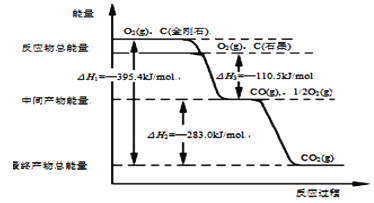
题目内容
【题目】常温下,分别向NaX溶液和YCl溶液中加入盐酸和氢氧化钠溶液,混合溶液的PH与离子浓度变化关系如图所示,下列说法不正确的是( )
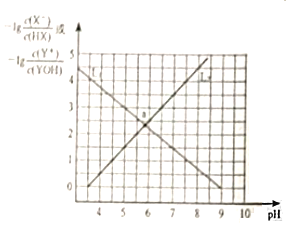
A.0.1mol/L的YX溶液中离子浓度关系为:c(Y+)>c(X-)>c(OH-)>c(H+)
B.L1表示-lg![]() 与pH的变化关系
与pH的变化关系
C.Kb(YOH)=10-10.5
D.a点时两溶液中水的电离程度不相同
【答案】A
【解析】
NaX溶液中加入盐酸,随着溶液pH逐渐逐渐增大,X-离子浓度逐渐增大,HX浓度逐渐减小,-lg![]() 的值逐渐减小,所以曲线L1表示-lg
的值逐渐减小,所以曲线L1表示-lg![]() 的与pH的关系;YCl溶液中加入NaOH溶液,随着溶液pH逐渐增大,Y+离子逐渐减小,YOH的浓度逐渐增大,则-lg
的与pH的关系;YCl溶液中加入NaOH溶液,随着溶液pH逐渐增大,Y+离子逐渐减小,YOH的浓度逐渐增大,则-lg![]() 的值逐渐增大,则曲线L2表示-lg
的值逐渐增大,则曲线L2表示-lg![]() 与pH的变化关系。
与pH的变化关系。
A.曲线L1中,-lg![]() =0时,c(X-)=c(HX),Ka(HX)=c(H+)=1×10-9>1×10-10.5,根据Kh=
=0时,c(X-)=c(HX),Ka(HX)=c(H+)=1×10-9>1×10-10.5,根据Kh=![]() 可知,电离平衡常数越大,对应离子的水解程度越小,则水解程度X-<Y+,则MA溶液呈酸性,则c(OH-)<c(H+)、c(Y+)<c(X-),溶液中离子浓度大小为:c(X-)>c(Y+)>c(H+)>c(OH-),故A错误;
可知,电离平衡常数越大,对应离子的水解程度越小,则水解程度X-<Y+,则MA溶液呈酸性,则c(OH-)<c(H+)、c(Y+)<c(X-),溶液中离子浓度大小为:c(X-)>c(Y+)>c(H+)>c(OH-),故A错误;
B.根据分析可知,曲线L1表示-lg![]() 的与pH的关系,故B正确;
的与pH的关系,故B正确;
C.曲线L2表示-lg![]() 与pH的变化关系,-lg
与pH的变化关系,-lg![]() =0时,c(Y+)=c(YOH),此时pH=3.5,c(OH-)=1×10-10.5mol/L,则Kb(YOH)=
=0时,c(Y+)=c(YOH),此时pH=3.5,c(OH-)=1×10-10.5mol/L,则Kb(YOH)=![]() =c(OH-)=1×10-10.5,故C正确;
=c(OH-)=1×10-10.5,故C正确;
D.a点溶液的pH<7,溶液呈酸性,对于曲线L1,NaX溶液呈碱性,而a点为酸性,说明加入盐酸所致,抑制了水的电离;曲线L2中,YCl溶液呈酸性,a点时呈酸性,Y+离子水解导致溶液呈酸性,促进了水的电离,所以水的电离程度:a<b,故D正确;
故答案为A。

【题目】某溶液中含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO![]() 、Ba2+、SO
、Ba2+、SO![]() 。现取3份该溶液各100 mL分别进行如下实验:
。现取3份该溶液各100 mL分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体,在标准状况下体积为2.24 L |
③ | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为12.54 g,第二次称量读数为4.66g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________(填“一定存在”“一定不存在”或“不能确定”);根据实验①~③判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol/L) |
__________ | |
(3)试确定K+是否存在 __________ (填“是”或“否”),判断的理是______________________。