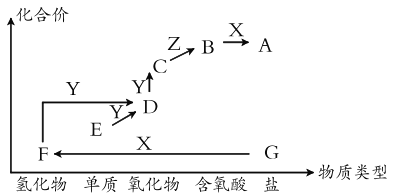
题目内容
【题目】元素周期表中的四种元素的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
长周期元素 | Z | Z的一种盐乙可以作净水剂,Z的某种氧化物丙可以做红色涂料 |
W | W元素大多存在于海藻种,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为___,X、Y、Z三种元素的简单离子半径从大到小的顺序为___。
(2)足量W的最高价氧化物的水化物是稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式:____。
(3)下列有关W的气态氢化物丁的说法正确的有___(选填字母)
a.丁比氯化氢沸点高 b.丁比氯化氢稳定性好
c.丁比氟化氢还原性弱 d.丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式___。
【答案】第三周期ⅢA族 r(Fe3+)>r(N3-)>r(Al3+) HIO4(aq)+![]() Al(OH)3(s)=H2O(l)+
Al(OH)3(s)=H2O(l)+![]() Al(IO4)3(aq) △H=-
Al(IO4)3(aq) △H=-![]() QkJ/mol a Fe2O3+6H++2I-=2Fe2++I2+3H2O
QkJ/mol a Fe2O3+6H++2I-=2Fe2++I2+3H2O
【解析】
氢氧化铝具有两性,X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液,X是Al元素;氨气作制冷剂,Y的一种氢化物可用于制造纯碱和做制冷剂,Y是N元素; 氧化铁是红色染料的成分,Z的一种盐乙可以作净水剂,Z的某种氧化物丙可以做红色涂料,Z是Fe元素;碘化银用于人工降雨,W元素大多存在于海藻种,它的银盐可用于人工降雨,W是I元素;
(1)X是Al元素,Al元素周期表中的位置为第三周期ⅢA族,电子层数越多半径越大,电子层数相同,质子数越多半径越小,Al3+、N3-、Fe3+三种离子半径从大到小的顺序为r(Fe3+)>r(N3-)>r(Al3+)。
(2)W的最高价氧化物的水化物是HIO4,甲是氢氧化铝;足量HIO4稀溶液与1mol Al(OH)3完全反应,放出热量QkJ,表示该过程中和热的热化学方程式是HIO4(aq)+![]() Al(OH)3(s)=H2O(l)+
Al(OH)3(s)=H2O(l)+![]() Al(IO4)3(aq) △H=-
Al(IO4)3(aq) △H=-![]() QkJ/mol。
QkJ/mol。
(3)a.HI的相对分子质量大于HCl,HI比氯化氢沸点高,故a正确;
b. Cl的非金属性大于I ,HCl比HI稳定性好,故b错误;
c. Cl的非金属性大于I, HI比氟化氢还原性强,故c错误;
d. HI是强酸,氢氟酸是弱酸,故d错误。
(4)铁的氧化物丙可以做红色涂料,丙是Fe2O3,丁是HI,Fe2O3与HI发生氧化还原反应生成FeI2和I2,反应的离子方程式是Fe2O3+6H++2I-=2Fe2++I2+3H2O。

 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】某溶液中含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO![]() 、Ba2+、SO
、Ba2+、SO![]() 。现取3份该溶液各100 mL分别进行如下实验:
。现取3份该溶液各100 mL分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体,在标准状况下体积为2.24 L |
③ | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为12.54 g,第二次称量读数为4.66g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________(填“一定存在”“一定不存在”或“不能确定”);根据实验①~③判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol/L) |
__________ | |
(3)试确定K+是否存在 __________ (填“是”或“否”),判断的理是______________________。