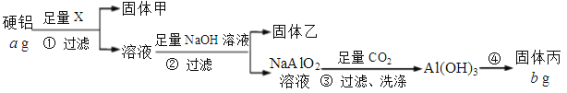
题目内容
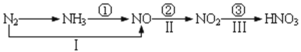
【题目】Ⅰ、某实验小组同学进行如下实验,以检验化学反应中的能量变化。请回答下列问题:

(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是________,Ba(OH)28H2O与NH4Cl的反应是________.反应过程________(填“①”或“②”)的能量变化可用图2表示。
(2)现有如下两个反应:A、NaOH+HCl=NaCl+H2O;B、2FeCl3+Cu=2FeCl2+CuCl2,以上两个反应能设计成原电池的是________,负极材料为:________,电解质溶液为:________,负极的电极反应式为:________。
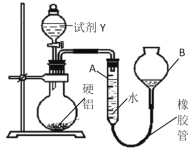
Ⅱ、某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律
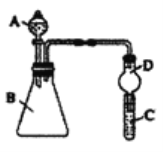
(1)仪器A的名称为________,干燥管D的作用为________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________(填现象)即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用NaOH溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中可加________溶液,观察到C中溶液________(填现象),即可证明,反应的离子方程式为:________,但有的同学认为该实验不严谨,应在两装置间添加装有________溶液的洗气瓶,目的是________。
【答案】放热反应 吸热反应 ① B Cu FeCl3溶液 Cu﹣2e﹣=Cu2+ 分液漏斗 防止倒吸 溶液颜色变蓝 Na2SiO3或K2SiO3 变浑浊,产生白色胶状物 SiO32-+CO2(少量)+H2O=CO32-+H2SiO3↓或者SiO32-+2CO2(过量)+2H2O=2HCO3-+H2SiO3↓ 饱和NaHCO3 盐酸具有挥发性,挥发出的HCl气体会干扰实验,用饱和碳酸氢钠溶液不仅可以除杂,还可以产生更多的CO2。
【解析】
(1)①发生铝条与盐酸的反应,反应后中的温度升高,说明反应过程中放出热量,为放热反应;②Ba(OH)28H2O与NH4Cl反应,反应后温度降低,说明该反应吸收能量,为吸热反应;图2中反应物的总能量高于产物的总能量,表示的为放热反应的能量变化,可用来表示铝与盐酸的反应过程中能量变化,故答案为:放热反应;吸热反应; ①。
(2)原电池的原理是氧化还原反应,而A反应为酸碱中和属于复分解反应,B反应有化合价的变化可以设计成原电池,结合反应方程式2FeCl3+Cu=2FeCl2+CuCl2,铜化合价升高应做负极材料,比铜不活泼的金属或石墨做正极,负极的反应为:Cu﹣2e﹣=Cu2+;电解质溶液为FeCl3,故答案为:B;Cu;FeCl3溶液;Cu﹣2e﹣=Cu2+。
Ⅱ、(1)根据仪器的构造可知A为分液漏斗,D干燥管的作用是防止气体进入试管后产生倒吸,故答案为:分液漏斗;防止倒吸。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),氯气再与C中碘化钾反应置换出碘单质,碘遇淀粉变蓝,故答案为:溶液颜色变蓝。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、盐酸与碳酸钙反应产生二氧化碳,二氧化碳通入硅酸盐溶液中产生硅酸白色胶状沉淀,反应的离子方程式为:SiO32-+CO2(少量)+H2O=CO32-+H2SiO3↓或者SiO32-+2CO2(过量)+2H2O=2HCO3-+H2SiO3↓,从而可知酸性:碳酸>硅酸,则非金属性:C>Si;但是因盐酸具有挥发性,产生的二氧化碳中会混有氯化氢,而氯化氢也能与硅酸盐反应产生硅酸沉淀,因此应该在通入硅酸盐溶液前用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体,以防干扰。故答案为:Na2SiO3或K2SiO3;变浑浊,产生白色胶状物;SiO32-+CO2(少量)+H2O=CO32-+H2SiO3↓或者SiO32-+2CO2(过量)+2H2O=2HCO3-+H2SiO3↓;饱和NaHCO3;盐酸具有挥发性,挥发出的HCl气体会干扰实验,用饱和碳酸氢钠溶液不仅可以除杂,还可以产生更多的CO2。

【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是
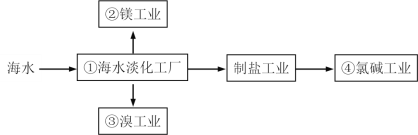
A.①中可采用蒸馏法B.②中可通过电解法制金属镁
C.③中提溴涉及到复分解反应D.④的产品可生产盐酸、漂白液等
【题目】某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的数据如下表所示:

实验编号 | 水果种类 | 电极间距离/cm | 电流大小/μA |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹果 | 2 | 27.2 |
(1)该实验的目的是探究水果种类和________对水果电池电流大小的影响。
(2)上图所示的装置中,做负极的材料是______(填“锌片”或“铜片”),该装置给将_________转变为电能。
(3)能表明水果种类对电流大小有影响的实验编号是____和_______。
(4)请你再提一个可能影响水果电池电流大小的因素:______________ 。