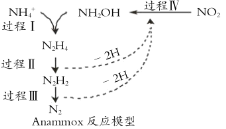
题目内容
【题目】现用固体KOH配制0.1 mol/L的KOH溶液 480 mL,回答下列问题:
(1)配制过程中需要用到的玻璃仪器有______。
(2)需要用托盘天平称量______g KOH固体。
(3)如果在定容时仰视操作,则所配得溶液的浓度______0.1 mol/L(填>,=,<)。
(4)若所用的固体KOH中混有NaOH,则所配得溶液的c(OH-)浓度______0.1 mol/L (填>,=,<)。
【答案】烧杯、玻璃棒、量筒、500 mL容量瓶和胶头滴管 2.8 < >
【解析】
(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)由于实验室无480 mL容量瓶,故应选择500 mL的容量瓶,故配制出500 mL溶液,根据所需的氢氧化钾的质量m=c·V·M来计算;
(3)根据c=![]() 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)氢氧化钠的摩尔质量小于氢氧化钾。
(1)由于实验室无480 mL容量瓶,故应选择500 mL的容量瓶,根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为烧杯、玻璃棒、量筒、托盘天平、500 mL容量瓶和胶头滴管,配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、500 mL容量瓶和胶头滴管;
(2)由于实验室无480 mL容量瓶,根据选择仪器的标准“大而近”的原则,应选择500 mL的容量瓶,配制出500 mL溶液,所需的氢氧化钾的质量m=c·V·M=0.1 mol/L×0.5 L×56 g/mol=2.8 g;
(3)定容时仰视,则溶液体积偏大,由于溶质的物质的量不变,根据c=![]() 可知该浓度小于0.1 mol/L;
可知该浓度小于0.1 mol/L;
(4)由于氢氧化钠的摩尔质量比氢氧化钾小,故根据n=![]() 可知:所称量的固体的质量不变,由于物质摩尔质量变小,则溶质的物质的量偏大,使所配得溶液的c(OH-)浓度大于0.1 mol/L。
可知:所称量的固体的质量不变,由于物质摩尔质量变小,则溶质的物质的量偏大,使所配得溶液的c(OH-)浓度大于0.1 mol/L。