题目内容
2.同温同压下,m g气体A与n g气体B的分子数目相同,下列说法中不正确的是( )| A. | 气体A与气体B的相对分子质量之比为m:n | |
| B. | 同质量的气体A与气体B,所含分子数目之比为n:m | |
| C. | 相同条件下,等体积的气体A与气体B的质量之比为m:n | |
| D. | 相同条件下,气体A与气体B的密度之比为n:m |
分析 同温同压下,m g气体A与n g气体B的分子数目相同,则物质的量相同.
A、物质的量相同时,气体的质量与摩尔质量即相对分子质量成正比;
B、质量相等时,摩尔质量和物质的量成反比;
C、相同条件下,等体积的气体的物质的量相等,而等物质的量的物质的质量之比等于摩尔质量之比;
D、同温同压下,气体的密度之比等于摩尔质量之比.
解答 解:同温同压下,m g气体A与n g气体B的分子数目相同,则物质的量相同.
A、物质的量相同时,气体的质量与摩尔质量即相对分子质量成正比,故气体A和气体B的相对分子质量之比为m:n,故A正确;
B、质量相等时,摩尔质量和物质的量成反比,由于气体A和气体B的相对分子质量之比即摩尔质量之比为m:n,故等质量的两者的物质的量之比为n:m,而分子数目之比等于物质的量之比,故分子数目之比为n:m,故B正确;
C、相同条件下,等体积的气体A和气体B的物质的量相等,而等物质的量的物质的质量之比等于摩尔质量之比,故气体A和气体B的质量之比为m:n,故C正确;
D、同温同压下,气体的密度之比等于摩尔质量之比,故气体A和气体B的密度之比为m;n,故D错误.
故选D.
点评 本题考查阿伏伽德罗定律及其推论,明确同温、同压、同体积,则气体的分子数相同、物质的量相同及质量、物质的量、摩尔质量的关系是解答的关键.

练习册系列答案
相关题目
12.在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L•min) | |
| B. | 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L•min) | |
| C. | 反应到6 min时,H2O2分解了50% | |
| D. | 反应到6 min时,c(H2O2)=0.30 mol/L |
13.相对分子质量为M的某物质在室温下溶解度为Sg,此时测得饱和溶液的密度为dg•mL-1,则该饱和溶液的物质的量浓度是( )
| A. | $\frac{M}{10Sd}$ mol•L-1 | B. | $\frac{100Sd}{M(100+S)}$ mol•L-1 | ||
| C. | $\frac{10Sd}{M}$mol•L-1 | D. | $\frac{M(100+S)}{1000Sd}$ mol•L-1 |
17.元素A的阳离子与元素B的阴离子具有相同的电子层结构.以下关于A、B元素的比较中,不正确的是( )
| A. | 原子半径:A<B | B. | 原子序数:A>B | ||
| C. | 原子最外层电子数:B>A | D. | 元素所在的周期数:A>B |
7.改变外界条件可以影响化学反应速率,针对H2(g)+I2(g)?2HI(g),其中能使活化分子百分数增加的是
①增加反应物浓度 ②增大气体的压强 ③升高体系的温度 ④使用催化剂( )
①增加反应物浓度 ②增大气体的压强 ③升高体系的温度 ④使用催化剂( )
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
14.我国女科学家屠呦呦发现青蒿素,它是一种用于治疗疟疾的药物,2015年10月获得诺贝尔生理 医学奖.下列有关青蒿素(化学式:C15H22O5)叙述正确的是( )
| A. | 青蒿素的摩尔质量为282 | |
| B. | 6.02×1023个青蒿素分子的质量约为282g | |
| C. | 1 mol青蒿素的质量为282g•mol-1 | |
| D. | 282g青蒿素中含有15个碳原子 |
11.一定条件下,在容积为1L的密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g),1min后测得生成0.06mol NH3,则该段时间内N2的化学反应速率(mol?L-1?min-1)为( )
| A. | 0.01 | B. | 0.02 | C. | 0.03 | D. | 0.06 |
12.实验室里用下列仪器和药品制取纯净的无水氯化铜.根据要求填写下列空白:
(1)如果按气体从左向右流时,②在④左边时,则②中加入液体的名称是饱和食盐水(填名称).
(2)装置⑥中发生反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O.
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻离管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿色.
(4)某小组推理反应结束后,⑤中一定有HCl剩余,请设计实验判断这一结论是否正确?加碳酸钠有气泡.
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 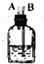 |  |  |  | 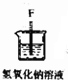 |
(2)装置⑥中发生反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O.
(3)实验开始时,应先点燃⑤(填装置序号)处的酒精灯,否则CuCl2中含有CuO(填化学式)杂质.待充分反应后,装置①的玻离管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿色.
(4)某小组推理反应结束后,⑤中一定有HCl剩余,请设计实验判断这一结论是否正确?加碳酸钠有气泡.
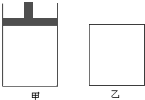 将4mol SO2与2mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)?2SO3(g);△H<0,在相同温度下使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答:
将4mol SO2与2mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)?2SO3(g);△H<0,在相同温度下使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答: