题目内容
4.硫及其化合物对人类的生产和生活有着重要的作用.(1)把SO2气体通入下列溶液中,不能产生沉淀的是b.
a.Ba(NO3)2 b.BaCl2 c.H2S d.溶有NH3的BaCl2溶液 e.Na2SiO3溶液
(2)Na2S2O3溶液是定量实验中的常用试剂.实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需胶头滴管、500mL容量瓶.Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
(3)配平下面化学方程式
3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①在上述反应中表现出来的性质是c(选填序号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标况下的体积是4.48L.
分析 (1)SO2气体可被氧化性物质氧化为硫酸根离子,硫酸钡不溶于水和酸;或发生强酸制取弱酸的反应生成不溶性硅酸,或发生氧化还原反应生成S等,二氧化硫为酸性氧化物,与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡沉淀,据此解答;
(2)依据配制一定物质的量浓度溶液的一般步骤选择仪器;Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,则氯气被还原为氯离子;
(3)反应中C从0价升高到二氧化碳中的+4价,K2Cr2O7中的Cr从+6价降为Cr2(SO4)3中的+3价,依据氧化还原反应得失电子守恒规律结合原子个数守恒规律配平方程式;
①依据硫酸在反应中元素化合价变化情况判断硫酸表现的性质;
②依据方程式3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O,每生成3mol二氧化碳,转移电子数为3mol×(4-0)=12mol,计算生成二氧化碳的物质的量,依据V=nVm计算标况下体积.
解答 解:(1)a.硝酸根离子在酸性环境下具有强的氧化性,二者发生氧化还原反应,生成硫酸钡沉淀,故A不选;
b.盐酸酸性强于亚硫酸,二氧化硫与氯化钡溶液不反应,不会产生沉淀,故b选;
c.二者发生氧化还原反应生成硫单质沉淀,故c不选;
d.二氧化硫为酸性氧化物,与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡沉淀,故d不选;
e.二者反应生成硅酸沉淀,故e不选;
故选:b;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容等,用到的仪器除了烧杯、量筒、玻璃棒外,还需要胶头滴管、500mL容量瓶;
Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,则氯气被还原为氯离子,离子反应为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+,
故答案为:胶头滴管、500mL容量瓶;S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+;
(3)反应中C从0价升高到二氧化碳中的+4价,K2Cr2O7中的Cr从+6价降为Cr2(SO4)3中的+3价,要使氧化剂得到电子数等于还原剂失去电子数,则C系数为3,K2Cr2O7系数为2,依据原子个数守恒,反应的方程式:
3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O;
故答案为:3;2;8;2;3;2;8;
①硫酸在反应中元素化合价不变,所以只表现酸性,故选:c;
故选:c;
②依据方程式3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O,每生成3mol二氧化碳,转移电子数为3mol×(4-0)=12mol,所以若反应中电子转移了0.8mol,则产生的气体的物质的量为0.2mol,标况下体积为0.2mol×22.4L/mol=4.48L;
故答案为:4.48L;
点评 本题考查了二氧化硫的性质、氧化还原反应方程式配平、电子转移数目的计算,明确氧化还原反应得失电子守恒规律,熟悉二氧化硫的性质是解题关键,题目难度中等.

| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L•min) | |
| B. | 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L•min) | |
| C. | 反应到6 min时,H2O2分解了50% | |
| D. | 反应到6 min时,c(H2O2)=0.30 mol/L |
| A. | 增加C的量 | |
| B. | 将容器的体积减小一半 | |
| C. | 保持体积不变,充入氮气使体系的压强增大 | |
| D. | 保持压强不变,充入氮气使体系的体积增大 |
| A. | $\frac{M}{10Sd}$ mol•L-1 | B. | $\frac{100Sd}{M(100+S)}$ mol•L-1 | ||
| C. | $\frac{10Sd}{M}$mol•L-1 | D. | $\frac{M(100+S)}{1000Sd}$ mol•L-1 |
| A. | 青蒿素的摩尔质量为282 | |
| B. | 6.02×1023个青蒿素分子的质量约为282g | |
| C. | 1 mol青蒿素的质量为282g•mol-1 | |
| D. | 282g青蒿素中含有15个碳原子 |
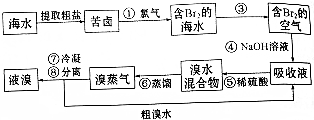
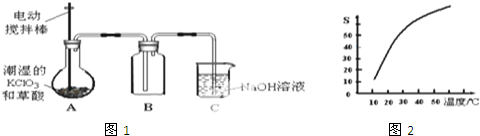
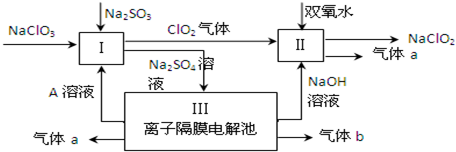
 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时刻达到平衡,如图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时刻达到平衡,如图所示: