题目内容
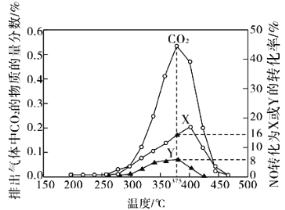
【题目】常温下,向20mL0.10mol·L-1HClO溶液中逐滴加入0.10mol·L-1NaOH溶液,滴定过程中溶液中水电离出的c(H+)变化曲线如图所示。下列说法正确的是
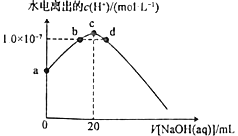
A.可用pH试纸测定a点溶液的pH
B.b、c、d三点溶液中离子、分子种类不同
C.a、b、c、d四点溶液中水的电离程度:c>b=d>a
D.d点溶液中c(Na+)=c(ClO-)
【答案】C
【解析】
A.次氯酸溶液具有漂白性,不能用pH试纸测定a点溶液的pH,故A错误;
B.b、c、d三点溶液中离子种类相同,都含有钠离子、次氯酸根离子氢氧根离子和氢离子,分子种类也相同,含有H2O和HClO,故B错误;
C.结合反应过程可知,a、b、c、d四点溶液中,a点是HClO溶液,抑制水的电离,水的电离程度最小;c点为次氯酸钠溶液,水解促进水的电离,水的电离程度最大; b点为HClO和次氯酸钠的混合溶液,呈中性,d点为次氯酸钠和NaOH的混合溶液,呈碱性,溶液碱性比c点强,根据图像,b、d两点水电离出的氢离子浓度相等,水的电离程度相等,水的电离程度:c>b=d>a,故C正确;
D.d点溶液呈碱性,c(H+)<c(OH-),根据电荷守恒,c(Na+)>c(ClO-),故D错误;
故选C。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目