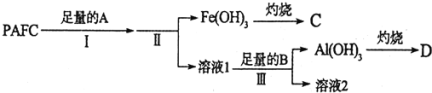
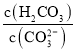题目内容
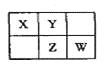
【题目】A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题:
(1)W的最高价氧化物化学式是________________;Z的原子结构示意图为______。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为_____________。
(3) AW3可用于净水,其原理是_____________。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是__________________。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
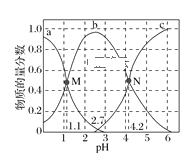
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)_______________________________。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式____________________。
【答案】Cl2O7  Al(OH)3+NaOH=NaAl(OH)4 Al3++3 H2O
Al(OH)3+NaOH=NaAl(OH)4 Al3++3 H2O![]() Al(OH)3(胶体)+3H+ d c(NO3-)>c(H+)>c(NH4+)>c(OH-) 2ClO2+2CN-=N2+2Cl-+2CO2
Al(OH)3(胶体)+3H+ d c(NO3-)>c(H+)>c(NH4+)>c(OH-) 2ClO2+2CN-=N2+2Cl-+2CO2
【解析】
A是地壳中含量最多的金属元素,所以A为Al,短周期主族元素中B的原子半径最大,所以B为Na,根据图中位置,可知Z元素为三个电子层,最外层电子数是电子层数的2倍,可以推出Z原子核外排布是2,8,6,所以Z元素是S,以此为突破口,可以推出X为N,Y为O,W为Cl。
(1)W(Cl)的最高价氧化物化学式是Cl2O7;Z(S)的原子结构示意图为 。
。
(2)A、B各自最高价氧化物对应的水化物分别为Al(OH)3和NaOH,反应的化学方程式为Al(OH)3+NaOH=NaAl(OH)4。
(3)AW3(AlCl3)可用于净水,其原理是Al3+水解生成的Al(OH)3胶体能吸附水中的杂质,方程式为Al3++3 H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(4)合成氨气是放热反应,升高温度所以逆向移动,转化率变小;加入催化剂,只是加快化学反应速率,转化率不变;将氨气移走,虽然提高了转化率,但是化学反应速率降低;加大压强,加快了化学反应速率,正向移动,提高了原料的转化率,所以选d。
(5)标准状况下,2.24L(0.1mol)NH3与100 mL l mol L-1(0.1mol)HNO3反应恰好生成0.1molNH4NO3,因为NH4+会发生水解,所以c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
(6)根据题意,反应物是ClO2和CN-,CN-中的N化合价是-3,C化合价是+2,再根据氧化成两种无毒气体,判断出无毒气体是N2和CO2,CN-中N和C化合价均升高,所以ClO2中Cl的化合价只有降低,判断出应该生成Cl-,然后用化合价升降法和电荷守恒配平:2ClO2+2CN-=N2+2Cl-+2CO2。

【题目】类比推理是学习化学的重要的思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
陈述Ⅰ | 类比推理陈述Ⅱ | |
A | 单质的熔点Br2 < I2 | 单质的熔点Li < Na |
B | 工业上电解熔融的Al2O3得到铝单质 | 工业上电解熔融的MgO得到镁单质 |
C | 还原性:I- > Br- | 还原性:P3- > N3- |
D | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
A.AB.BC.CD.D