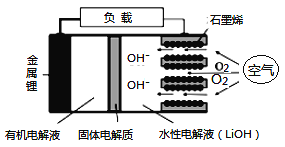
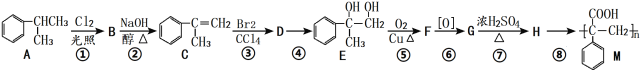
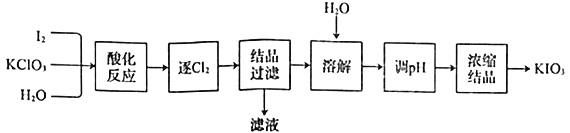
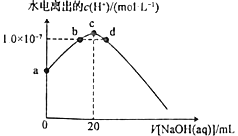
题目内容
【题目】锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:[Zn(CN)4]2-+4HCHO+4H2O=Zn2++4HOCH2CN+4OH-
回答下列问题:
(1)基态Zn2+的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___________,HOCH2CN分子中含有的σ键与π键数目之比为_________。
(3)HCHO分子中碳原子轨道的杂化类型是________,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是_________________________。
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为_________,提供孤电子对的成键原子是________。
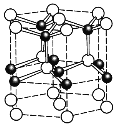
(5)ZnO的一种最稳定的晶体结构如图所示,晶胞中Zn2+的配位数为______。六棱柱底边长为acm,高为bcm,设阿伏加德罗常数的值为NA,则ZnO的密度为_______ g/cm3(列出计算表达式)。
【答案】[Ar]3d10 4 N>O>C 3:1 sp2 HCHO与水分子间存在氢键 配位键 C 4 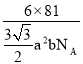
【解析】
(1)基态Zn的电子排布式为[Ar]3d104s2,基态Zn2+的就是[Ar]3d10;C原子核外电子占据4个不同原子轨道,2个s轨道,2个p轨道;
(2)同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C ; HOCH2CN分子结构式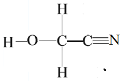 ,单键均为σ键,三键中σ键与π键数目之比为1∶2, 合计σ键6个,π键2个,σ键与π键数目之比为3:1;
,单键均为σ键,三键中σ键与π键数目之比为1∶2, 合计σ键6个,π键2个,σ键与π键数目之比为3:1;
(3)因为它是平面三角形的,或者说从碳原子的键型也可以看出来有两个单键,一个双键, 其中共有3个σ键,所以为sp2杂化;HCHO与水分子间存在氢键,故HCHO极易与水互溶;
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为配位键,提供孤电子对的成键原子是C原子;
(5)晶胞中与Zn2+紧挨着的O原子有4个,Zn2+的配位数为4;
1个晶胞中有Zn2+(白色)3种,顶点12个,面心2个,体心3个,完全属于这个晶胞的Zn2+:12×![]() +2×
+2×![]() +3 =6个,O2-(黑色)在棱上有6个,体心有4个,完全属于这个晶胞的O2-有:6×
+3 =6个,O2-(黑色)在棱上有6个,体心有4个,完全属于这个晶胞的O2-有:6×![]() +4=6个;1个晶胞底面积为
+4=6个;1个晶胞底面积为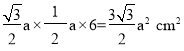 ,体积为
,体积为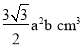 ,1mol ZnO有晶胞
,1mol ZnO有晶胞![]() 个,1mol ZnO体积为
个,1mol ZnO体积为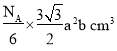 ,1mol ZnO质量是81g,则ZnO的密度为
,1mol ZnO质量是81g,则ZnO的密度为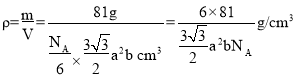 。
。