题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
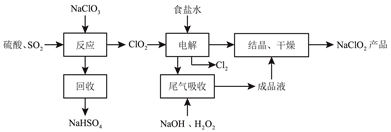
已知:亚氯酸钠在温度高于80℃时分解。下列说法不正确的是( )
A. “反应”步骤中生成ClO2的化学方程式是:2NaClO3+SO2+H2SO4===2NaHSO4+2ClO2
B. 电解食盐水的阴极产物是NaOH和H2
C. ClO2尾气吸收时氧化剂和还原剂的物质的量之比为1:1
D. 从NaClO2溶液中得到NaClO2产品,应采用减压蒸发的方法
【答案】C
【解析】A. 由生产工艺可知,NaClO3在H2SO4作用下和SO2反应生成ClO2和NaHSO4,根据得失电子守恒和质量守恒,此反应的化学方程式为:2NaClO3+SO2+H2SO4===2NaHSO4+2ClO2,故A正确;
B. 电解食盐水时,阴极发生的反应是2H2O+2e-=H2+2OH-,故阴极得到的产物是NaOH和H2,故B正确;
C. 依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2,产物为ClO2,则此反应中ClO2为氧化剂,还原产物为ClO2,氯元素化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1,故C错误
D. 因亚氯酸钠在温度高于80℃时分解,故从NaClO2溶液中得到NaClO2产品,应采用减压蒸发的方法以防止亚氯酸钠分解,故D正确;
故答案选C。

【题目】欲用下图装置对所制备的气体进行除杂检验,其设计方案合理的是
制备气体 | X(除杂试剂) | Y(检验试剂) |
| |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | 电石与NaCl水溶液 | H2O | Br2的水溶液 | |
C | C2H5OH与浓硫酸加热至170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 |
A. A B. B C. C D. D
