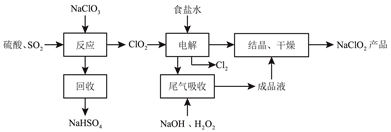
题目内容
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的物质的量为_______mol,NO2的物质的量为________mol。
(2)待产生的气体全部释放后,向溶液加入VmL、amolL-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为_______mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中企部转化为NaNO3,至少需耍30%的双氧水______g。
【答案】 0.26 0.24 (aV.10-3+0.5)/0.14 57.8
【解析】试题分析:铜与一定浓度的硝酸反应所涉及的化学方程式为:
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+NO2;![]() 3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO
3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO![]() ;
;
(1)设NO的体积为![]() L,则NO2的体积为
L,则NO2的体积为![]() L,由上述方程式可知①与稀硝酸反应的铜的质量为
L,由上述方程式可知①与稀硝酸反应的铜的质量为![]() ;②与浓硝酸反应的铜的质量为
;②与浓硝酸反应的铜的质量为![]() 。因此可得如下等式:
。因此可得如下等式:![]() ,解得
,解得![]() 。NO的物质的量是
。NO的物质的量是![]() ;NO2的物质的量是
;NO2的物质的量是![]() 0.24mol。
0.24mol。
(2)根据氮元素守恒,原硝酸的物质的量浓度![]() (aV.10-3+0.5)/0.14 ;
(aV.10-3+0.5)/0.14 ;
(3)发生的反应为2NO2+H2O2=2HNO3、2NO+3H2O2=2HNO3+2H2O。设与NO2反应的H2O2的质量为![]() ,与NO反应的H2O2的质量为
,与NO反应的H2O2的质量为![]() ,则可得如下关系式:
,则可得如下关系式: ![]() 、
、![]() ,解得a=4.08g、b=13.26g,因此需要30%的双氧水的质量为
,解得a=4.08g、b=13.26g,因此需要30%的双氧水的质量为![]() 。
。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目