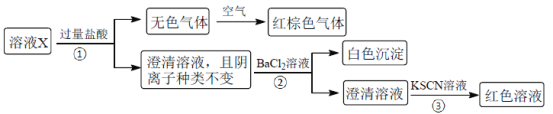
题目内容
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
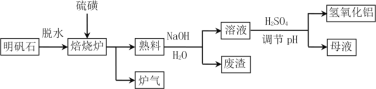
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
【答案】Al2(SO4) 3 3.612×1024 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) Al2O3 +2OH- =2AlO2- + H2O K2SO4 Na2SO4 取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净
【解析】
(1)所含元素化合价降低的反应物是氧化剂;再根据N=nNA转移电子数目;
(2)根据反应后溶液中溶质为NaHSO3,溶液呈碱性,判断溶液中各离子的浓度大小;
(3)熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠;
(4)母液中离子主要为K+,Na+,SO42-;通过检验硫酸根离子的方法进行试验。
(1)反应中硫元素的化合价由Al2(SO4)3中的+6价降低为SO2的+4价,故Al2(SO4)3为氧化剂,反应中硫单质中硫元素的化合价由0价升高为SO2的+4价,硫单质为还原剂,生成1molAl2O3时需要硫的物质的量为1mol×3/2=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024,故答案为:故Al2(SO4)3,3.612×1024。
(2)1.12L二氧化硫的物质的量为1.12L÷22.4L/mol=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=1:1,故反应后溶液中溶质为NaHSO3,溶液呈碱性,说明HSO3-的电离程度大于水解程度,同时水解生成氢离子,故c(H+)>c(SO32-),HSO3-的电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中各种离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
(3)由工艺流程可以知道,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,离子方程式为:Al2O3 +2OH- =2AlO2- + H2O,故答案为:Al2O3 +2OH- =2AlO2- + H2O。
(4)由工艺流程可以知道,熟料溶解所得到的溶液中含有K+,Na+,SO42-,AlO2-,OH-等,加硫酸调节pH值,AlO2-转化为Al(OH)3,母液中离子主要为K+,Na+,SO42-,含有溶质为K2SO4、Na2SO4;Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行试验,方法为取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,故答案为:K2SO4、Na2SO4;取最后一次洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净。

 备战中考寒假系列答案
备战中考寒假系列答案