题目内容
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.20mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
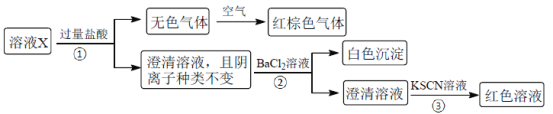
下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.由步骤③可知,原溶液肯定存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
【答案】D
【解析】
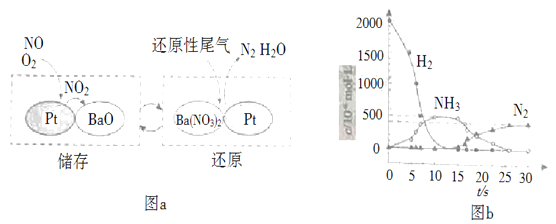
X溶液加入盐酸,生成无色气体,气体遇到空气变为红棕色,则可说明生成NO,X中一定含有NO3-和还原性离子Fe2+;亚铁离子存在,则一定不存在CO32-、OH-、SiO32-;加入盐酸后阴离子种类不变,则说明X中含有Cl-,加入氯化钡生成白色沉淀,则一定含有SO42-;加入KSCN溶液呈红色,因Fe2+被氧化成Fe3+,则不能证明X中是否含有Fe3+,已知该溶液中各离子物质的量浓度均为0.2molL-1,依据阴阳离子所带电荷数守恒,可知一定含有Mg2+,不含Fe3+、K+,所以溶液中一定含有的离子为:Fe2+、Cl-、NO3-、SO42-、Mg2+。
A.溶液中没有碳酸根离子,因此X加入盐酸反应生成的无色气体中一定不含二氧化碳,故A错误;
B.因为第一步加入的盐酸后硝酸根离子能够将亚铁离子氧化生成铁离子,不能确定原溶液中是否存在铁离子,故B错误;
C.溶液X中所含离子:Fe2+、Cl-、NO3-、SO42-、Mg2+,共有5种,故C错误;
D.另取100mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到固体为0.01molFe2O3和0.02molMgO,质量为0.01mol×160g/mol+0.02mol×40g/mol=2.4g,故D正确;
故选D。

 全能练考卷系列答案
全能练考卷系列答案