题目内容
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
Ⅰ、金属Ca的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca+H2![]() CaH2(固体)
CaH2(固体)
Ⅱ、固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑;②CaH2要密封保存。
【进行实验】
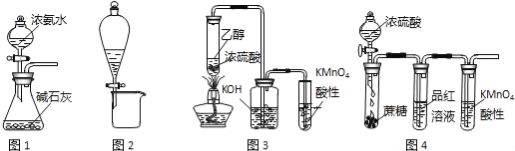
该小组同学设计的制取装置如图所示(固定装置略).

回答下列问题:
(1)写出Ca常温遇水发生反应的化学方程式: 。
(2)B、D中所盛试剂相同,该试剂为 (填名称);D中该试剂的作用是 。
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: 。
【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2 样品,按图所示连接仪器(固定装置略)。
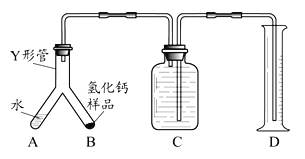
步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL。
(4)若该实验条件下的气体摩尔体积为Vm L/mol,当V= mL时(用m、Vm表示),表明制得的CaH2样品是纯净的。
【答案】(1)Ca+2H2O=Ca(OH)2+H2↑(3分)
(2)浓硫酸(2分);防止空气中的水蒸汽进入C装置(2分)
(3)排除装置内的空气,防止钙与氧气反应,也防止不纯的氢气加热时发生爆炸(4分)
(4)![]() (3分)
(3分)
【解析】
试题分析:(1)Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,发生反应的化学方程式为Ca + 2H2O=Ca(OH)2 + H2↑。
(2)因为氢化钙要密封保存,遇水反应生成氢氧化钙和氢气,钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热,所以该反应要在干燥的环境中进行,则B、D装置中盛的是浓硫酸,目的是干燥氢气,其中D中浓硫酸的作用是防止空气中的水蒸汽进入C中。
(3)金属钙的性质很活泼,所以实验时先打开A中活塞,一段时间后,再点燃C中酒精灯的目的是排除装置内的空气,防止钙与氧气反应,也防止不纯的氢气加热时发生爆炸。
(4)根据方程式CaH2 + 2H2O=Ca(OH)2 + 2H2↑可知1mol氢化钙生成2mol氢气,则mg氢化钙生成的氢气是![]() ,其体积是
,其体积是![]() ,所以当V=
,所以当V=![]() mL时,表明制得的CaH2样品是纯净的。
mL时,表明制得的CaH2样品是纯净的。

【题目】下表各组物质之间通过一步反应不可以实现如图所示的转化
关系是
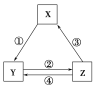
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
C | Fe2O3 | FeCl3 | Fe(OH)3 | ④加入盐酸 |
D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |