题目内容
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:

(1)用H2还原无水FeCl3制取FeCl2。有关装置如图1所示:
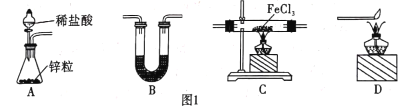
①H2还原无水FeCl3制取FeCl2的化学方程式为________ 。
②B中盛放的试剂是____,按气流由左到右的方向,上述仪器的连接顺序为 ____(填字母,装置可多次使用)。
③该制备装置的缺点为______。
(2)利用反应![]() ,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
,制取无水FeCl2并测定FeCl3的转化率。按图2装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
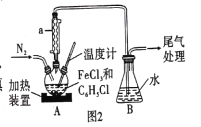
①仪器a的作用是 _______。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____(填名称),回收滤液中C6H5Cl的操作方法是____。
③在反应开始之前先通一段时间N2的目的是 ____,在反应完成后继续通一段时间N2的作用是____
④反应后将锥形瓶中溶液配成250 mL,量取25. 00 mL所配溶液,用0.40 mol·L-1 NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19. 50 mL、20. 50 mL、19. 70 mL,则氯化铁的转化率为____。
【答案】H2+2FeCl3![]() 2FeCl2+2HCl 碱石灰 ABCBD FeCl3、FeCl2易升华,蒸汽遇冷凝华易堵塞导管 冷凝回流 苯 蒸馏 排尽装置中的空气,以防止FeCl2被氧化 将反应生成的HCl全部排入装置B中 78.4%
2FeCl2+2HCl 碱石灰 ABCBD FeCl3、FeCl2易升华,蒸汽遇冷凝华易堵塞导管 冷凝回流 苯 蒸馏 排尽装置中的空气,以防止FeCl2被氧化 将反应生成的HCl全部排入装置B中 78.4%
【解析】
(1)H2还原无水FeCl3制取FeCl2,用A装置制取氢气,用B装置中的碱石灰干燥氢气,干燥后的氢气与无水FeCl3在C中发生反应:H2+2FeCl3![]() 2FeCl2+2HCl,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用D装置处理尾气,该装置的缺点是氯化铁易升华导致导管易堵塞,据此分析作答;
2FeCl2+2HCl,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用D装置处理尾气,该装置的缺点是氯化铁易升华导致导管易堵塞,据此分析作答;
(2)在A三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,发生反应:2FeCl3+C6H5Cl![]() 2FeCl2+3C6H4Cl2+HCl,反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,将滤液蒸馏,收集沸点132℃的馏分,回收C6H5Cl,为了减少实验误差,反应开始前先通N2一段时间,反应完成后继续通N2一段时间,将HCl完全被吸收,据此分析作答。
2FeCl2+3C6H4Cl2+HCl,反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,将滤液蒸馏,收集沸点132℃的馏分,回收C6H5Cl,为了减少实验误差,反应开始前先通N2一段时间,反应完成后继续通N2一段时间,将HCl完全被吸收,据此分析作答。
(1)①H2还原无水FeCl3制取FeCl2的化学方程式为:H2+2FeCl3![]() 2FeCl2+2HCl;
2FeCl2+2HCl;
故答案为:H2+2FeCl3![]() 2FeCl2+2HCl;
2FeCl2+2HCl;
②根据分析,流程为:用A装置制取氢气,用B装置干燥氢气,干燥后的氢气与无水FeCl3在C中发生反应,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用D装置处理尾气,故连接顺序为:ABCBD;C的目的是干燥氢气,吸收水蒸气,盛放的试剂是碱石灰;
故答案为:碱石灰;ABCBD;
③根据题意,FeCl3、FeCl2易升华,故该制备装置可能会因为FeCl3、FeCl2易升华,蒸汽遇冷凝华易堵塞导管;
故答案为:FeCl3、FeCl2易升华,蒸汽遇冷凝华易堵塞导管;
(2)①仪器a为球形冷凝管,作用为冷凝回流;
故答案为:冷凝回流;
②反应结束后,冷却实验装置A,三颈烧瓶内物质主要是产物FeCl2,还有多余的氯苯和副产物C6H4Cl2,由题可知,氯苯和副产物C6H4Cl2溶于苯,FeCl2不溶于苯,故洗涤所用的试剂可以是苯,减少产品的损失;滤液的溶质有氯苯和C6H4Cl2,由表可知,二者沸点相差较大,可用蒸馏的方法分离,故回收滤液中C6H5Cl的操作方法是蒸馏;
故答案为:苯;蒸馏;
③FeCl2易被空气氧化,在反应开始之前先通一段时间N2的目的是排尽装置中的空气,以防止FeCl2被氧化;为减小实验误差,在反应完成后继续通一段时间N2的作用是将反应生成的HCI全部排入装置B中;
故答案为:排尽装置中的空气,以防止FeCl2被氧化;将反应生成的HCI全部排入装置B中;
④32.5g无水氯化铁理论上生成的n(FeCl2)=n(FeCl3)=![]() ,3次滴定消耗NaOH溶液的体积分别为19. 50 mL、20. 50 mL、19.70 mL,其中20.5mL偏差较大,应该舍弃,则HCl消耗NaOH溶液的平均体积为19.60mL,则NaOH物质的量为0.0196L×0.4mol/L=0.00784mol,故反应生成的n(FeCl2)=2(HCl)=
,3次滴定消耗NaOH溶液的体积分别为19. 50 mL、20. 50 mL、19.70 mL,其中20.5mL偏差较大,应该舍弃,则HCl消耗NaOH溶液的平均体积为19.60mL,则NaOH物质的量为0.0196L×0.4mol/L=0.00784mol,故反应生成的n(FeCl2)=2(HCl)= ![]() ,故氯化铁的转化率为
,故氯化铁的转化率为![]() ;
;
故答案为:78.4%。

【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式_______。
(2)D的气态氢化物的VSEPR模型的名称为_______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比= _______________。
(4)要证明太阳上是否含有R 元素,可采用的方法是__________________________。
(5)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______________________。
(6)往O2+溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式_____。
(7)若F 、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为___。
(8)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__(填m、n、x或y)。

(9)1183 K以下纯N晶体的基本结构单元如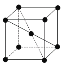 所示,1183 K以上转变为
所示,1183 K以上转变为 所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
所示结构的基本结构单元。在1183 K以下的晶体中,空间利用率为____;在1183 K以上的晶体中,与N原子等距离且最近的N原子数为____,晶体堆积方式的名称为_____。
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol