题目内容
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是______________。基态K+的电子排布式为__________________。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______________,中心原子的杂化方式为__________。NaBH4中存在__________(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为_________________。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:__________________________。
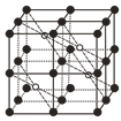
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=x pm,r(Ca2+)=y pm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=____________________g·cm-3(列出计算表达式)。
【答案】F>O>B 1s22s22p63s23p6 正四面体 sp3 ac ![]() 前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大
前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大 
【解析】
(1)元素的非金属性越强,电负性越大。氟代硼酸钾中非金属元素有F、O、B,非金属性强弱顺序为F>O>B,电负性大小顺序为F>O>B;基态K+核外电子总数为18,则电子排布式为1s22s22p63s23p6;
(2)BH4-的中心原子B原子孤电子对数=![]() =0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同为正四面体形,B原子采取sp3杂化;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键,没有氢键与π键,故答案为ac;
=0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同为正四面体形,B原子采取sp3杂化;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键,没有氢键与π键,故答案为ac;
(3)双聚分子为Be2Cl4,Be原子价电子数为2,形成2个Be-Cl键,Be原子有空轨道、Cl原子有孤电子对,每个BeCl2分子中的1个Cl原子另外分子中Be原子之间形成1个配位键,BeCl2的结构式为![]() ,其中Be的配位数为3;
,其中Be的配位数为3;
(4)氟化物的熔点与晶体类型,离子晶体的熔点较高,分子晶体的熔点较低;离子半径越小、电荷越大,晶格能越大,离子晶体的熔沸点越高。而相对分子质量越大,分子间作用力越强,分子晶体的熔沸点越高;NaF、MgF2和AlF3为离子晶体,晶格能依次增大,熔点依次升高,而SiF4、PF5和SF6为分子晶体,分子间力依次增大,熔点依次增大;
(5)晶胞中白色球数目为4、黑色球数目为1+8×![]() +6×
+6×![]() +12×
+12×![]() =8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据,可知Ca2+占据F-形成的空隙占有率为50%;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=
=8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据,可知Ca2+占据F-形成的空隙占有率为50%;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=![]() pm,故晶胞棱长=
pm,故晶胞棱长=![]() pm,晶胞相当于含有4个“CaF2”,晶胞质量=4×
pm,晶胞相当于含有4个“CaF2”,晶胞质量=4×![]() g,晶体密度
g,晶体密度 gcm-3。
gcm-3。

【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
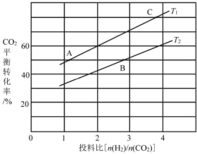
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。
(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%
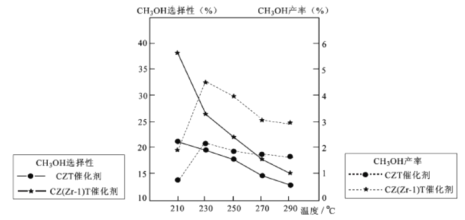
①温度高于230℃,CH3OH产率随温度升高而下降的原因是________。
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T
【题目】甘氨酸亚铁络合物[(NH2CH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如下:

已知:
甘氨酸(NH2CH2COOH ) | 异抗坏血酸 | 甘氨酸亚铁 | FeSO4.7H2O | FeCl2.4H2O |
易溶入水 | 易溶于水和乙醇 | 易溶于水 | 易溶于水 | 易溶于水 |
微溶于乙醇 | 有弱酸性和强氧化性 | 难溶于乙醇 | 难溶于乙醇 | 易溶于乙醇 |
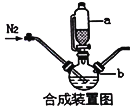
请回答:
(1)合成装置中仪器b的名称是____________
(2)合成过程中,为了防止亚铁被氧化,本实验中采取的措施是____________
(3)下列说法正确的是____________
A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞
B.根据题给信息,亚铁盐应选用FeSO4·7H2O
C.步骤Ⅲ、步骤Ⅳ都有固液分离,可采用常压过滤,也可采用减压过滤
D.粗产品提纯操作为重结晶,过滤,洗涤,干燥,其中干燥过程最好选用真空干燥
(4)合成过程需控制pH=5.5,pH过低或过高都会使产率下降,试说明理由_________________
(5)步骤Ⅲ加入无水乙醇的目的是___________________________________________________
(6)产品纯度可用“凯氏定氮法”测定,测定过程分为以下四步:
I、将有机氮转换为硫酸铵 II、将铵盐转化为氨气蒸出
III、用试剂吸收氨气 IV、滴定
①以下装置可以完成II,III两步操作
②将下列操作按合理顺序排入:
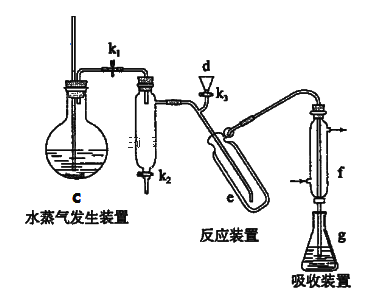
仪器清洗后,在g中加入吸收剂,然后将第I步获得的铵盐试样由d注入e→(_________)→(_________)→(_________)→(_________)→使水蒸气进入e,蒸馏几分钟后,将f下端提离液面并用少量蒸馏水洗涤清洗管口,停止加热c ,移去锥形瓶,立即用标准盐酸溶液进行滴定。
A.打开k1 B.关闭k3、k2 C.加热c D.由d注入氢氧化钠溶液,蒸馏水冲洗,并留少量液体作水封
②关于滴定过程下列说法正确的是____________
A.滴定管必须经检漏、洗涤、润洗后才能使用
B.标准盐酸溶液装入滴定管后,发现下端有气泡,可将橡皮管稍向上弯曲,挤压玻璃珠,气泡可被流水带出
C.滴定刚开始时,左手可以离开旋塞,让溶液自然流下
D.因为本测定方法较为精密和准确而操作过程繁琐,故产品纯度测定一次就可