��Ŀ����
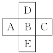
����Ŀ��(1)ǰ�������е�һ������ͼ����BԪ��ԭ������Ϊx����A��C��D��Eԭ������֮��Ϊ��________________��
(2)����������ΪN��R2����������ΪA��������n g���������������ӵ����ʵ�������______��mol
(3)����������Ϊ2��Ԫ���� _______ (��Ԫ�ط��ţ���ͬ)��
�����������������������ȵ�Ԫ����________
(4)����ʯ����Һ��ʯ����ʯ���������ѻ������ı仯�����У����ƻ���������������____ �� ____ �� ____________________
���𰸡�4X+10 n(A��N��8) /(A+16) He Be Mg Be Ar ���Ӽ������� ���Ӽ������� ���ۼ�
��������
(1)��ͼ����BԪ��ԭ������Ϊx�������λ�ÿ�֪A��C��D��Eԭ��������
(2)����������ΪN��R2����������ΪA���ֱ�����������������������������ʵ��������������������������ӵ����ʵ�����
(3)��ԭ�ӵĵ����Ų���֪��
(4)ʯ��������״̬ת���ƻ����Ƿ��Ӽ�����������ѧ��Ӧ�ƻ����ǹ��ۼ���
(1)ǰ�������е�һ������ͼ����BԪ��ԭ������Ϊx����AΪx-1��CΪx+1��DΪx-8��EΪx+18��A��C��D��Eԭ������֮��Ϊ4X+10��
(2)����������ΪN��R2����������ΪA������������RO��������Ϊ��A+16����������Ϊ��A-N+8������n g���������������ӵ����ʵ�����n(A��N��8) /(A+16) mol��
(3) ����������Ϊ2��Ԫ����He��Be��Mg�������������������������ȵ�Ԫ����Be��Ar��
(4)����ʯ����Һ��ʯ����ʯ���������ѻ������ı仯�����У����ƻ��������������Ƿ��Ӽ������������Ӽ������������ۼ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ijУ��ѧʵ��С���ڡ�̽����ˮ��FeCl2��Һ�ܷ�Ӧ����ϵ��ʵ���з��֣���������ϡKI��Һ�У�����1~2��FeCl3��Һ������Һ�ʻ�ɫ��
���������ϣ�
������ˮ�����ˮ��Һ��ɫ��Ũ�ȱ仯���ֻ�ɫ����ɫ����ˮ�к��еⵥ�ʣ���Fe3+����ҺҲ�ʻ�ɫ��
��������⣩
Fe3+��I2��������ǿ�������
��������룩
��1����ͬѧ��Ϊ������I2��Fe3+��������ʵ�������Ƿ�����ѧ��Ӧ���£�����Һ�ʻ�ɫ����Ϊ��______����ͬѧ��Ϊ������Fe3+��I2��������ʵ�������Ƿ�����ѧ��Ӧ���£�����Һ�ʻ�ɫ����Ϊ��_______��
�����ʵ�鲢��֤��
��2��Ϊ��֤��ͬѧ�Ĺ۵���ȷ����ͬѧѡ���������ṩ���Լ���Ƴ��������ַ�������ʵ�飬��������б���ѡ�õ��Լ���a����̪��Һ b�����Ȼ�̼ c����ˮ�ƾ� d��KSCN��Һ
���������б�����д����ͬѧѡ�õ��Լ���ʵ���й۲쵽�������Լ�����ţ�
�Լ� | ʵ������ | |
����1 | ____________ | ______ |
����2 | ______ | _________ |
��ʵ����ۣ�
�����ԣ�Fe3+��I2��
����չӦ�ã�
��3���ٸ�������ʵ���Ʋ⣬����FeI2��Һ��ͨ�����������ȱ�������������________��
����100mL FeI2��Һ��ͨ��2.24LCl2����״���£�����Һ������![]() ��Fe2+ �������������ӷ���ʽ��ʾ�÷�Ӧ���̣�___��
��Fe2+ �������������ӷ���ʽ��ʾ�÷�Ӧ���̣�___��


