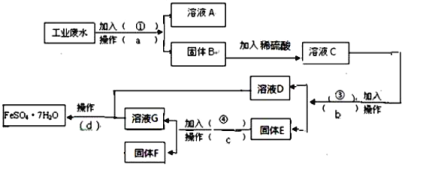
��Ŀ����
����Ŀ�������ȣ�SO2Cl2������Ҫ�Ļ�ѧ�Լ����������·�Ӧ��ȡ��SO2��g��+Cl2��g��![]() SO2Cl2��g����H��Ը÷�Ӧ�ش��������⣺
SO2Cl2��g����H��Ը÷�Ӧ�ش��������⣺
��1����֪����SO2��g��+Cl2��g��+SCl2��g��![]() 2SOCl2��g����H1=��akJmol��1
2SOCl2��g����H1=��akJmol��1
��SO2Cl2+SCl2��g��=2SOCl2��g����H2=��bkJmol��1
��a��b��0����H=______kJmol��1���ú�a��b�Ĵ���ʽ��ʾ��
��2��Ϊ����߸÷�Ӧ��Cl2��ƽ��ת���ʣ����д�ʩ��������______������ĸ��ţ���
a����С���������b��ʹ�ô�����c������SO2Ũ�ȡ�d�������¶�
��3�����ھ��ȡ����ݵ��ܱ���ϵ�У�Ͷ��һ����SO2��Cl2�������÷�Ӧ������ʾ��ͼ��˵��t1ʱ�̷�Ӧ�ﵽƽ��״̬����______������ĸ��ţ�������ͼ��������K��n��m�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ�����������

��4�����ڴ��������£���nmolSO2��nmolCl2�����ݻ��ɱ���ܱ������У���ʼ�ձ����¶�ΪT��ѹǿΪP����ʼʱ���������Ϊ10L��t minʱ��Ӧ�ﵽƽ��״̬����ʱ���������Ϊ8L��
�����ݻ��ı�������£���Ӧ���ʿ��õ�λʱ���ڷ�Ӧ�������������ʵ����仯����ʾ��������SO2��=____��
�����¶��£��÷�Ӧ��K=___��
����ͬ�����£�����0.5nmolSO2��0.5nmolCl2���������������ƽ��״̬ʱ���������SO2Cl2�����ʵ�����____��
��5���÷�Ӧ�IJ���SO2Cl2��ˮ��������ˮ����������ǿ�ᣬд���仯ѧ����ʽ____����֪25��ʱ��Ksp[AgCl]=1.8��10��10��Ksp[Ag2SO4]=1.4��10��5����SO2Cl2��ˮ������Һ����μ���AgNO3ϡ��Һʱ�����Ȳ����ij�����______��
���𰸡�����a��b�� AC BD ![]() mol/min
mol/min ![]() L/mol 0.2nmol SO2Cl2+2H2O=H2SO4+2HCl AgCl
L/mol 0.2nmol SO2Cl2+2H2O=H2SO4+2HCl AgCl
��������
(1)��SO2(g)+Cl2(g)+SCl2(g)2SOCl2(g)��H1=a kJmol��1
��SO2Cl2+SCl2(g)=2SOCl2(g)��H2=b kJmol��1
��˹���ɼ�����ڵõ���SO2(g)+Cl2(g)SO2Cl2(g)��H=(ab) kJmol��1��
�ʴ�Ϊ��(ab)��
(2)��߷�Ӧ��Cl2��ƽ��ת���ʣ��ı�����ʹƽ��������Ӧ�ƶ�����������������������
A. ��С�������,ѹǿ����,ƽ��������Ӧ�ƶ�,Cl2��ת��������A��ȷ��
B. ʹ�ô���,���̵���ƽ���ʱ��,��Ӱ��ƽ���ƶ�,Cl2��ת���ʲ��䣬��B����
C. ����SO2Ũ��,ƽ��������Ӧ�ƶ�,Cl2��ת��������C��ȷ��
D. �÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ,�����¶�,ƽ�����淴Ӧ�ƶ�,Cl2��ת���ʽ��ͣ���D����
�ʴ�Ϊ��AC��
(3)A������ƽ���������������ȣ����ٱ仯��t1ʱ��V�����֮�����ʲ��䣬��a����
B. �÷�Ӧ����ӦΪ���ȷ�Ӧ���淴Ӧ�����¶����ߣ���ѧƽ�ⳣ����С������ƽ����¶�Ϊ��ֵ��ƽ�ⳣ�����䣬Ϊ��С��ͼ����ʵ�ʷ��ϣ���B��ȷ��
C.t1ʱ�̺�SO2(g)��SO2Cl2(g)�����ʵ��������仯��t1ʱ��δ����ƽ��״̬����C����
D.t1ʱ��,SO2������Ϊ��ֵ������ƽ��״̬��ͼ����ʵ�ʷ��ϣ���D��ȷ��
��ѡBD��
(4)���ڴ��������£���nmolSO2��nmolCl2�����ݻ��ɱ���ܱ������У���ʼ�ձ����¶�ΪT��ѹǿΪP����ʼʱ���������Ϊ10L��tminʱ��Ӧ�ﵽƽ��״̬����ʱ���������Ϊ8L����μӷ�Ӧ�Ķ����������ʵ���Ϊx��
SO2(g)+Cl2(g)SO2Cl2(g)
��ʼ��(mol) n n 0
�仯��(mol) x x x
ƽ����(mol) nx nx x
�����¶�ΪT��ѹǿΪP���������֮�ȵ����������ʵ���֮�ȣ�2n:(2nx)=10:8��
x=0.4n��
�� ���ݻ��ı�������£���Ӧ���ʿ��õ�λʱ���ڷ�Ӧ�������������ʵ����仯����ʾ��
����(SO2)= ![]() mol/min���ʴ�Ϊ��
mol/min���ʴ�Ϊ��![]() mol/min��
mol/min��
���ݢٽ��ƽ��������,K�T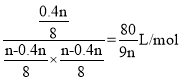 ��
��
�ʴ�Ϊ��![]() ��
��
�� ��nmolSO2��nmolCl2�����ݻ��ɱ���ܱ�������,�õ�SO2Cl20.4nmol�����ѹ������
����������ϵ����ͬ�����£�����0.5nmolSO2��0.5nmolCl2���������,����ƽ��״̬ʱ�����Ķ����������ʵ���Ϊ0.2n���������SO2Cl2�����ʵ�����0.2nmol��
�ʴ�Ϊ��0.2nmol��
(5)SO2Cl2��ˮ��������ˮ��,�Ҳ���������������ˮ������HCl�������ˮ����������£���SO2���Ž��2��OH����H2SO4,��Ӧ����ʽΪ��SO2Cl2+2H2O=H2SO4+2HCl
�ʴ�Ϊ��SO2Cl2+2H2O=H2SO4+2HCl��AgCl��

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�