题目内容
17.25℃,将0.010 0mol•L-1的 NaOH 溶液滴入浓度为0.010 0mol•L-1,体积为20.00mL的 CH3COOH 溶液.在滴加过程中 n(CH3COOH) 和 n(CH3COO-) 随溶液 pH 的分布关系如图.下列说法不正确的是( )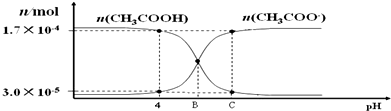
| A. | 醋酸的电离常数的表达式如下Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ | |
| B. | pH=4 时,醋酸的电离常数 Ka≈1.8×10-5 | |
| C. | B点时的溶液中滴入酚酞溶液,显红色 | |
| D. | C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) |
分析 A.根据电离平衡常数的概念及表达式进行判断;
B.根据pH=4时氢离子浓度、醋酸、醋酸根离子的浓度计算;
C.根据醋酸的电离平衡常数计算出此时溶液中氢离子浓度及溶液的pH;
D.根据醋酸的电离平衡常数及此时醋酸、醋酸根离子的物质的量计算出氢离子浓度,然后判断溶液酸碱性,然后根据电荷守恒判断各离子浓度大小.
解答 解:A.醋酸在溶液中部分电离出氢离子和醋酸根离子,则醋酸的电离常数的表达式为Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,故A正确;
B.pH=4时氢离子为1×10-4mol/L,设此时溶液体积为VL,则醋酸的电离常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{\frac{3×1{0}^{-5}mol}{VL}×1×1{0}^{-4}mol/L}{\frac{1.7×1{0}^{-4}mol}{VL}}$≈1.8×10-5,故B正确;
C.B点时n(CH3COOH)=n(CH3COO-),则c(CH3COOH)=c(CH3COO-),根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=1.8×10-5可知:c(H+)=1.8×10-5mol/L,此时溶液显示酸性,则滴入酚酞后溶液为无色,故C错误;
D.B、C点温度相同,则Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=1.8×10-5,则C点溶液中氢离子浓度为:c(H+)=$\frac{1.8×1{0}^{-5}×3×1{0}^{-5}}{1.7×1{0}^{-4}}$mol/L=3.18×10-6mol/L,此时溶液为酸性,c(H+)>c(OH-),根据电荷守恒可得:c(CH3COO-)>c(Na+),所以C点溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D正确;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,正确计算出醋酸的电离平衡常数为解答关键,注意掌握电荷守恒、盐的水解原理在判断离子浓度大小中的应用方法,试题侧重考查了学生的分析、理解能力.

 名校课堂系列答案
名校课堂系列答案| A. | NA代表阿伏加德罗常数,1molC4H10中含共价键数目为14NA | |
| B. | 某反应的△H=-88kJ•mol-1,则正反应活化能一定小于88kJ•mol-1 | |
| C. | 已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9 | |
| D. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
| A. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 苯酚钠溶液与少量二氧化碳反应:2C6H5O-+CO2+H2O→2 C6H5OH+CO32- | |
| C. | 在碳酸氢钠溶液中加入过量的氢氧化钡溶液:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ |
| A. | 无色透明的溶液中:Cl-,Br-,Na+,Cu2+ | |
| B. | 含有大量ClO-的溶液中:SO42-,Cu2+,I-,Fe2+ | |
| C. | 使pH试纸变蓝的溶液中:CO32-,Cl-,F-,K+ | |
| D. | 水电离出c(H+)=1×10-12的溶液中:Ca2+,HCO3-,Mg2+,NO3- |
| A. | 由H、N、O三种元素形成的化合物中一定含有共价键 | |
| B. | 正戊烷、异丁烷和丙烷属于同系物,沸点依次升高 | |
| C. | 葡萄糖能发生银镜反应,蔗糖、麦芽糖也能发生银镜反应 | |
| D. | 用KSCN溶液检验Fe3+的实验现象是产生血红色沉淀 |
| A. | 实验室用锌与稀硫酸反应时,滴加少量硫酸铜溶液能加快反应速率,因为硫酸铜是催化剂 | |
| B. | 某温度下,一定体积的密闭容器中进行可逆反应:X(g)+Y(g)=Z(g)+W(g)△H>0,平衡后加入一定量X,则△H增大 | |
| C. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| D. | 将NaAlO2溶液与NaHCO3溶液混合后生成白色沉淀,是两种溶液水解相互促进的结果 |
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 铜表面易形成致密的氧化膜 | |
| C. | 将CO2通入次氯酸钙溶液可生成次氯酸 | |
| D. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 |
| A. | 若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径 | |
| B. | 若M属于离子化合物,则该化合物中只存在离子键,且每个原子均达到8电子稳定结构 | |
| C. | 若最外层电子数X>Y>2,则X的非金属性一定比Y的非金属性强 | |
| D. | 若X和Y处于同一周期,且M属于共价化合物,则分子中原子个数比可能为1:2 |