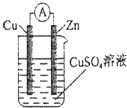
题目内容
12.下列各组指定溶液中,能够大量共存的是( )| A. | 无色透明的溶液中:Cl-,Br-,Na+,Cu2+ | |
| B. | 含有大量ClO-的溶液中:SO42-,Cu2+,I-,Fe2+ | |
| C. | 使pH试纸变蓝的溶液中:CO32-,Cl-,F-,K+ | |
| D. | 水电离出c(H+)=1×10-12的溶液中:Ca2+,HCO3-,Mg2+,NO3- |
分析 A.有颜色离子不能大量共存;
B.ClO-具有强氧化性,且易发生水解;
C.使pH试纸变蓝的溶液呈碱性;
D.水电离出c(H+)=1×10-12的溶液,可能酸性或碱性.
解答 解:A.Cu2+蓝色,不能大量共存,故A错误;
B.ClO-具有强氧化性,与还原性离子I-、Fe2+不能共存,故B错误;
C.使pH试纸变蓝的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故C正确;
D.水电离出c(H+)=1×10-12的溶液,可能酸性或碱性,与HCO3-均不能共存,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.芳香族羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.
反应原理:
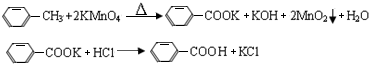
反应试剂、产物的物理常数:
主要实验装置和流程如下:
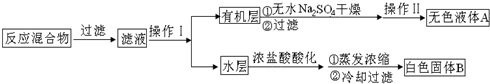
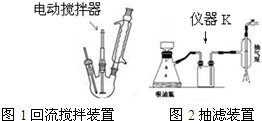
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
(1)图2仪器K的名称为安全瓶.无色液体A的结构简式为 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
反应原理:

反应试剂、产物的物理常数:
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |


实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
(1)图2仪器K的名称为安全瓶.无色液体A的结构简式为
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
3.下列有关阳离子的说法中错误的是 ( )
①非金属原子不能形成阳离子;
②阳离子都是由一个金属原子失去电子而形成的;
③阳离子的价态不会大于其原子的最外层电子数;
④阳离子都是稳定结构,不会再失去电子;
⑤阳离子的电子排布一定与稀有气体元素原子相同.
①非金属原子不能形成阳离子;
②阳离子都是由一个金属原子失去电子而形成的;
③阳离子的价态不会大于其原子的最外层电子数;
④阳离子都是稳定结构,不会再失去电子;
⑤阳离子的电子排布一定与稀有气体元素原子相同.
| A. | ①④⑤ | B. | ②③④ | C. | ①②③ | D. | ①②③④⑤ |
20.下列说法不正确的是( )
| A. | iPhone5外壳易掉色原因是,铝壳表面氧化处理过程中作为阳极的金属铝纯度不够 | |
| B. | 道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| C. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| D. | 古代的陶瓷、砖瓦,现代的普通玻璃、水泥都是硅酸盐产品 |
7.常温下,下列叙述正确的是( )
| A. | 1.0×10-3 mol•L-1盐酸的pH=3.0,1.0×10-7.5 mol•L-1盐酸的pH=7.5 | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 在醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b | |
| D. | 若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
17.25℃,将0.010 0mol•L-1的 NaOH 溶液滴入浓度为0.010 0mol•L-1,体积为20.00mL的 CH3COOH 溶液.在滴加过程中 n(CH3COOH) 和 n(CH3COO-) 随溶液 pH 的分布关系如图.下列说法不正确的是( )
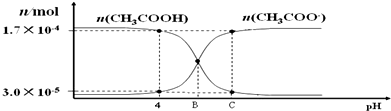

| A. | 醋酸的电离常数的表达式如下Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ | |
| B. | pH=4 时,醋酸的电离常数 Ka≈1.8×10-5 | |
| C. | B点时的溶液中滴入酚酞溶液,显红色 | |
| D. | C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) |
4.四种短周期元素在周期表中的位置如图,其中Y的最高价氧化物对应的水化物能与其氢化物反应生成盐.下列说法正确的是( )
| Y | |||
| M | X | Z |
| A. | 钠与Z可能形成只含离子键的Na2Z、Na2Z2化合物 | |
| B. | X的最高价氧化物不与任何酸反应 | |
| C. | Y的最简单气态氢化物的热稳定性比X的强,因为Y的最简单气态氢化物分子间存在氢键 | |
| D. | M的简单离子半径是同周期中简单离子半径最小的 |
2.部分弱电解质的电离平衡常数如下表.
下列说法不正确的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 结合H+的能力:CO32->CN->HCO3->HCOO- | |
| B. | 0.1mol/L的HCOONH4溶液中存在以下关系式:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 在25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,c(NH4+)=c(SO42-) | |
| D. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |